
Бесплатный фрагмент - Боль в пояснице
Вместо предисловия
«Раньше миром управляли умные. Это было жестоко.
Умные заставляли тупых учиться. Тупым было тяжело.
Теперь миром управляют тупые. Это честно, потому что тупых гораздо больше.
Теперь умные учатся говорить так, чтоб тупым было понятно.
Если тупой что-то не понял, это умного проблема.
Раньше страдали тупые. Теперь страдают умные.
Страданий стало меньше, потому что умных становится всё меньше и меньше.
Мир изменился к лучшему.
Теперь, когда пишешь, сам должен стараться, чтоб тебя поняли.
Писать короткими словами.
Разбавлять писанину шутками.
О, дивный новый мир!»
Артем Голиков
Введение
85% населения Земли хотя бы раз в жизни сталкивались с болью в спине. Несмотря на то, что причины и механизмы возникновения боли в спине хорошо изучены, вопрос предотвращения повторных эпизодов и хронизации до сих пор не решен. И связано это с тем, что, большинство людей просто не понимают всей сложности и специфики данного «заболевания».
Первое: боль в спине — это или симптом, или часть синдрома (совокупности симптомов, характерных для конкретного заболевания), а не диагноз. Спина может болеть от чего угодно. Наличие сильных болей не говорит о наличии серьезной патологии, также верно, что боль в спине может быть симптомом тяжелых соматических заболеваний, напрямую не связанных с позвоночником.
Второе: при неправильном лечении и реабилитации банальные скелетно-мышечные боли могут спровоцировать запуск более серьезных заболеваний позвоночника, привести к хронизации процесса или стать причиной инвалидности.
Третье: «боль в спине» берутся лечить все, кому не лень; отрасль буквально кишит шарлатанами и псевдоспециалистами, которые наносят ощутимый урон, как здоровью пациентов, так и репутации реальных специалистов, работающих с данной категорией больных.
Четвертое: терминология. Первый признак шарлатанства — оперирование обобщающими терминами «боль в спине» и/или «остеохондроз». С юридической точки зрения правильно говорить «боль в спине вследствие…» и добавлять конкретную причину. Выставить диагноз имеют право только врачи, закончившие медицинские ВУЗы. Доктора остеопатии, хиропрактики, реабилитологи и прочие массажисты вообще не имеют права выставлять какие-либо диагнозы или озвучивать свои альтернативные «диагнозы».
Причины болей в нижней части спины (пояснице) официально разделяют на две большие группы: неспецифические («механические») и специфические, связанные с тяжелыми заболеваниями.
Приведу пример одной из классификаций (по Виллеру, 2013).
Дифференциальная диагностика боли в пояснице
Механические синдромы:
Дисфункция крестцово-подвздошного сустава.
Дегенеративные изменения в диске и фасеточных суставах на уровне определенного сегмента.
Миофасциальная боль и болевые синдромы.
Дискогенная боль.
Радикулопатия вследствие импинджмента (сдавления), связанного со структурными изменениями.
Аксиальная или корешковая боль, связанная с биохимической или воспалительной реакцией на травму.
Переломы позвоночно-двигательного сегмента или позвонков.
Спондилез с или без центрального или бокового стеноза.
Макронестабильность/микронестабильность позвоночника с/без рентгенографической гипермобильностью или признаками подвывиха.
Синдром грушевидной мышцы.
Синдром илиотибиального тракта.
Вертлужный бурсит.
Немеханические синдромы
Неврологические синдромы:
Миелопатия или миелит, связанные с внутренними/наружными структурными или сосудистыми процессами.
Пояснично-крестцовая плексопатия (напр. при диабете, васкулитах, злокачественной опухоли).
Острая, подострая или хроническая полиневропатия (например, острая и хроническая воспалительная демиелинизирующая полиневропатия, диабет).
Мононевропатия, включая каузалгию (травма, диабет).
Миопатия, включая миозит и различные метаболические заболевания.
Спинальная сегментарная, тазово-поясничная или генерализованная дистония.
Системные заболевания:
Первичные или метастатические опухоли.
Инфекция (например, инфекция костной ткани, дискового или эпидурального пространства).
Воспалительная спондилоартропатия.
Нарушение метаболизма костной ткани (например, остеопороз).
Сосудистые нарушения (атеросклероз, васкулит).
Отраженная боль:
Желудочно-кишечные заболевания (панкреатит, рак поджелудочной железы, холецистит).
Кардиореспираторные расстройства (перикардит, плеврит, пневмония).
Заболевание ребер или грудины.
Заболевания мочеполовой системы (нефролитиаз, простатит, пиелонефрит, эндометриоз, внематочная беременность).
Аневризмы грудной или брюшной аорты.
Заболевания тазобедренного сустава (травма, воспаление, дегенерация сустава/сухожилий/суставной сумки/связок).
(Wheeler et al. Low back pain and sciatica. 2013)
На причины боли, связанной с серьезной патологией и симптомами, относящимися к категории «красные флаги», приходиться порядка 5 — 10%.
Если после клинического обследования с использованием критериев «красных флагов» из перечня специфических заболеваний ничего не обнаружено, то боль в спине, если она острая, скорее всего, будет связана с такими причинами как: миофасциальный синдром — банальное повреждение мышц, фасций, связок, капсул межпозвонковых суставов, разрыв межпозвонкового диска или грыжеобразование с последующей корешковой болью/радикулопатией. Если боль имеет хроническое течение, то, скорее всего, она уже будет связана с такими причинами как: дегенеративное поражение диска — 26—42%, дегенеративное поражение фасеточных суставов — 38—42%, поражение крестцово-подвздошного сустава — 2—18%, стеноз позвоночного канала — 2% и дегенеративное поражение связочного аппарата позвоночника как сопутствующее в 50% случаев. Также к причинам хронической боли в пояснице можно отнести поражение тазобедренного сустава.
Под понятием «поражение» следует понимать дегенеративно–дистрофические (часто возрастные) изменения, которые стали причиной боли, и дегенеративные заболевания (например, межпозвонковый остеохондроз), в основе которых лежит генетическая предрасположенность.
Сам протокол лечения острой боли при первичном обращении пациента предполагает «отсечение» от общей группы обратившихся за медицинской помощью пациентов с симптомами опасности («красные флаги»). При отсутствии угрожающей симптоматики до сведения пациента доводиться информация о том, что нет повода подозревать тяжелую патологию и что чем быстрее пациент вернется к привычной деятельности, тем быстрее произойдет «выздоровление».
При правильном подходе:
40% заболевших «выздоравливают» в течение 1 недели;
80% заболевших «выздоравливают» в течение 3 недель;
90% пациентов «выздоравливают» в течение 6 недель;
Только в 10% случаев испытывают симптомы в течение> 6 месяцев;
Только в 1% случаев требуется хирургическое вмешательство.
Сама по себе рекомендация возврата к «привычной деятельности» является спорной, поскольку под «привычной деятельностью» можно подразумевать все, что угодно: от 8—12 часового просиживания в офисе или за рулем грузовика (дальнобойщики), до вкалывания подсобником на стройплощадке. Для некоторых пациентов лежание на диване — это тоже привычный вид деятельности.
Основным методом предупреждения повторных обострений и хронизации боли в спине является адекватная физическая реабилитация, которая включает в себя индивидуально подобранный двигательный режим, ходьбу средним темпом на длинные дистанции и упражнения для стабилизации и/или мобилизации суставов. Все остальные методы профилактики/предупреждения повторных обострений не нашли научного подтверждения своей эффективности, что и получило отражение в клинических руководствах на основе доказательной медицины.
Если через 6 недель после возникновения боли симптоматика сохраняется, то повторно пересматривается протокол медикаментозного лечения и вносятся коррективы в протокол реабилитации.
На данный момент считается, что при отсутствии симптомов опасности («красных флагов») в первый месяц заболевания не оправдано назначение лабораторных исследований и проведение визуализационных исследований (КТ, МРТ, лучевая диагностика). Прямых корреляций между степенью дегенеративно-дистрофических изменений опорно-двигательного аппарата, силой боли и степенью нетрудоспособности/инвалидизации не обнаружено. Случайные находки (грыжи, протрузии, остеофиты, сужение позвоночного канала) могут быть неправильно проинтерпретированы и искусственно «привязаны» к «заболеванию», что может вызвать у пациента катастрофизацию сознания и уход в болезнь. Так называемый эффект ноцебо — обострение физических симптомов болезни и ухудшение общего состояния без явных на то оснований. Также не стоит сбрасывать со счетов и коммерческую составляющую исследований и прямую финансовую заинтересованность медицинских центров, предоставляющих услуги визуальной/лабораторной диагностики или лечения данной группы пациентов. Прямая корреляция между болью и визуальными находками обнаружена только для дегенеративной болезни диска (межпозвонковый остеохондроз) на уровнях L4-L5 и L5-S1 при наличии изменений по Модику 1 типа. [На основании обследования 2475 лиц (до 50 лет) с болью в пояснице положительная прогностическая ценность (PPV) данного маркера составила 81% и специфичность 98%. Встречаемость протрузий у бессимптомных от 20 до 63%; межпозвонковые грыжи — от 0 до 24%] (Rahyussalim et al., 2020).
Довольно часто переход острой боли в хроническую связан не с визуальной «тяжестью» поражения структур опорно-двигательного аппарата, а обусловлен неправильным (избыточным) лечением и неадекватной реабилитацией простой острой.
Также существуют признаки и симптомы («желтые флаги») при наличии которых предполагается, что острая боль трансформируется в хроническую:
Наличие у пациента психических расстройств в анамнезе. Повышенная тревога по поводу того, что проблемы со спиной опасны. Наличие общей тревожности, депрессия, стресс, социальная изоляция.
Соматизация; нарушение сна из-за болей в спине.
Наличие у пациента социально-экономических проблем.
Профессиональные факторы: профессия, связанная с поднятием тяжестей, неопределенные, четко не оговоренные рабочие требования, высокая умственная нагрузка, длительный перерыв в работе, неудовлетворенность работой, отсутствие поддержки на работе, проблемы с претензиями или компенсациями, отсутствие экономической выгоды от возобновления работы, работники лесного хозяйства.
Наличие социальных или экономических трудностей (например, развод, смерть члена семьи, потеря работы). Чрезмерная опека семьи/партнера, отсутствие социальной поддержки.
Поведенческие факторы (избегание нагрузки из-за страха нанесения себе увечий и кинезиофобия) и отношение к заболеванию: неадекватная оценка собственного состояния или отсутствие уверенности в его улучшении, уверенность в способности продолжать работать, нежелание улучшать физический уровень, продолжительный отдых.
Ожидание, что пассивное лечение (физические факторы/агенты, длительный постельный режим) лучше, чем активное участие (упражнения, прогулки, работа) для выздоровления.
Высокий балл по шкале поведения избегания страха.
Высокий балл по шкале кинезиофобии.
Разное:
Путаница в отношении диагноза и прогноза, непонимание причины боли, негативный опыт предыдущего вмешательства по поводу болей в спине, иммиграционный статус.
Удельный вес или вклад факторов, влияющих на возникновение и поддержание боли в спине (Cholewicki et al., 2017)
Индивидуальные факторы — 8,8%: возраст, семейная история боли, ожирение, биомеханические особенности анатомии, прошлая история боли в спине, женщины более склонны к развитию боли, наличие знаний о боли в спине, гибкость, сила мышц разгибателей, знания о здоровье и пр.
Коморбидность — 3,9%: диабет, метаболический синдром, возрастная сарко-, и остеопения и т. п.
Поведенческие, стиль жизни — 11,1%: низкая физическая активность, курение, степень вовлечения в лечебный и реабилитационный процесс; плохой сон, диеты, жизненные требования/притязания, сидячий образ жизни.
Биомеханические факторы — 13%: нарушение моторного контроля, суммарная механическая нагрузка, предъявляемые физические требования и физическая перегрузка, репертуар движения, мышечный дисбаланс, нейромышечные паттерны, хорошая осанка, ручной труд, оптимальный моторный контроль, подъем тяжести, длительное сидение, адаптивный моторный ответ, неоптимальные моторные стратегии, кумулятивная механическая перегрузка, амплитуда движения, сила региональных мышц, частые сгибания, наклоны и скручивающие движения.
Ноцицепция и процессинг/обработка и декодирование «болевого» сигнала — 9,7%: центральная и периферическая сенситизация, вовлечение нейроматрикса, наличие гипералгезии, аллодинии, нарушение болевого процессинга.
Психологические — 28,1%: неприятный сенсорный или эмоциональный опыт, эмоциональная боль, негативные воспоминания или убеждения, слабый контроль за жизненными событиями, страх боли, катастрофизация боли, негативный жизненный опыт (боль, злоупотребления, насилие) стратегии преодоления и их резерв, ощущение угрозы, стратегии избегания, позитивные психологические факторы, ментальные проблемы, стресс, страх боли, позитивное психологическое подкрепление, когнитивные функции.
Социальные/средовые/рабочие/контекстуальные — 13%: культурные убеждения, автономность работы, религиозные убеждения, рабочий и социальный статус, финансовая стабильность, вовлечение в судебные разбирательства и претензии на компенсацию по потере трудоспособности, низкий доход, вознаграждение, удовлетворение работой, вторичные выгоды, отношения на работе.
Контекстуальные факторы: доступность мед помощи, вовремя оказанная помощь и ее качество, убеждения лечащего врача, вовремя поставленный диагноз, негативные контекстуальные факторы, доступ к группам поддержки, позитивный опыт, требования от окружающих, экономические возможности.
Травма или патология ткани — 12,5%: механическое повреждение ткани, артрит фасеточных суставов, негативный иммунный ответ, грыжа диска, стеноз, травма, артрит крестцово-подвздошного сустава, текущее воспаление, общий провоспалительный статус, дегенеративная болезнь диска, повреждение/старение клеток, механическая боль, повышенный уровень цитокинов, патологическая иннервация, остеопороз, переломы, мышечное перенапряжение, нестабильность позвоночника, дистрофия паравертебральных мышц, повреждение фасций, вертеброгенная патология, спондилоартропатии.
Учитывая полифакториальность боли в спине в основе эффективной реабилитации лежат
Обучение пациента: даются адаптированные к потребностям и возможностям пациента рекомендации и предоставляется информация, способствующая самостоятельной реабилитации, озвучиваются реальные сроки длительности ожидаемого курса реабилитации и эффективные варианты ухода за собой, совет оставаться активным на протяжении всего курса.
При назначении лечебной физкультуры (упражнения/двигательный режим) учитывается механизм поражения (отдельно составляются комплексы при гипермобильности/нестабильности позвоночника, отдельно при ригидности/тугоподвижности, для части пациентов подходит тракционное лечение).
Мануальная терапия (манипуляции на позвоночнике, мобилизация суставов или техники на мягких тканях) используется как часть пакета лечения, включающего физические упражнения, с психологической терапией или без нее.
— Когнитивно-поведенческая терапия: как часть комплекса лечения, включая физические упражнения, с или без мануальная терапия.
— Мультидисциплинарная биопсихосоциальная реабилитация (мультимодальная реабилитация): комбинирование физической и психологической реабилитации, используют вмешательства, включающее когнитивно-поведенческие методы, если у пациента возникли значительные психосоциальные препятствия, ограничивающие выздоровление или когда предыдущее лечение не было эффективно.
При хронической боли в спине (более 3-х месяцев) НЕ рекомендуется
Тракционная терапия, биологическая обратная связь, массаж, чрескожная электрическая стимуляция нервов, терапевтическое УЗИ, электротерапия, лазерная терапия, интерференционная терапия, мышечные релаксанты, габапентин, пилатес, иглоукалывание, остеопатия, корсетирование поясницы, тейпирование, опиоиды, постуральные упражнения или проприоцептивное обучение, слинг — терапия, ортопедические стельки, ношение пояса или специальная обувь (Malfliet et al., 2019).
Данные методы лечения и реабилитации не рекомендуются вследствие их высокой стоимости в сочетании с их клинической неэффективностью (или эффективностью на уровне плацебо) если рассматривать механизм их действия с учетом патогенеза боли в спине. Зачастую применение данных методов усугубляет течение заболевания (например, тракционное лечение, миорелаксанты, длительное ношение корсета).
В некоторых зарубежных руководствах массаж, иглоукалывание, антидепрессанты рекомендуются, но скорее как «традиционные» рекомендации.
Когда боль возникает в первый раз, то большинство пациентов, не раздумывая, идет к врачу. Решение, однозначно, правильное. Но когда количество приступов боли в спине со временем увеличивается и стандартное лечение не так уж и помогает, то сознание обывателя подталкивает изменить стратегию лечения — обратиться не к врачу, а к смежным специалистам, также занимающимся решением данной проблемы. Хорошо если это будут настоящие специалисты по реабилитации. Куда хуже, если это будут представители шарлатанских течений, выдающих себя за экспертов в области лечения болей в спине. Брожение от одних «специалистов» к другим сродни ходьбе по тонкому льду. Как показывает практика, не всем удается «перейти на тот берег» целым и невредимым. Как, впрочем, такая участь уготована и тем, кто полагается на самостоятельное изучение вопроса и самолечение.
Кто и как будет лечить боль в спине?
1) представители официальной медицины; 2) представители комплементарной медицины; 3) представители альтернативной медицины; 4) самолечение по рекомендациям «соседки, которой помогло».
Ниже представлена краткая характеристика каждого типа лечения с некоторыми комментариями.
[Трактовка из общедоступных источников. В основном Википедия для удобства перепроверки].
Официальная медицина
Официальная медицина — система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни, предупреждение и лечение болезней человека и животных, а также облегчения страданий от физических и психических недугов. Также известна как «ортодоксальная», доказательная, научная, «западная» медицина. Сторонники альтернативных методов лечения часто называют ее «аллопатической» медициной.
Состоит из теоретической и практической медицины.
Теоретическая медицина (биомедицина) исследует теоретические основы лечения, предлагает пути развития практической медицины. Теоретическая медицина основана на логическом медицинском мышлении, подтверждённом научными теоретическими знаниями.
Практическая (клиническая) медицина — практическое применение накопленных медицинской наукой знаний, для лечения заболеваний и патологических состояний человеческого организма.
В современной медицинской науке всё шире применяются критерии доказательной медицины. Это позволяет привести медицину к общему знаменателю, избавить диагнозы и клинические методики от зависимости от мнений отдельных, пусть и авторитетных, людей в пользу объективных критериев диагностики, лечения и дальнейшего прогноза течения заболеваний.
Один из отцов доказательной медицины американо-канадский врач Дэвид Саккет определил доказательную медицину как систематическое использование лучших из существующих доказательств эффективности при выборе метода лечения.
Основной принцип доказательной медицины — прозрачность. Любое клиническое решение (выбор варианта лечения из возможных альтернатив) должно быть обосновано доказательствами, которые могут быть проверены другими людьми.
Второй принцип — равноправие. Авторитет, статус и личный опыт не должны влиять на выбор лечения, такой выбор должен основываться на высококачественных доказательствах преимуществ конкретного вмешательства.
Таким образом, Доказательная медицина (англ. evidence-based medicine) — подход к медицинской практике, при котором решения о применении профилактических, диагностических и лечебных вмешательств принимаются, исходя из имеющихся доказательств их эффективности и безопасности, а такие доказательства подвергаются оценке, сравнению, обобщению и широкому распространению для использования в интересах пациентов. Другими словами — это медицина, основанная на доказательствах.
Доказательная медицина требует строгого подтверждения эффективности и безопасности тех или иных методов лечения, профилактики или диагностики путем методологически корректно выполненных рандомизированных контролируемых испытаний — двойных слепых с плацебо-контролем. Любые другие методы, не получившие такого методологического подтверждения эффективности, рассматриваются как нерелевантные и неэффективные, вне зависимости от их кажущейся эффективности в открытых исследованиях, когда некоторые участники исследования знают, какое именно воздействие получает пациент. Такой подход является основным в западной медицине.
Классическую, ортодоксальную медицину обозначают как Конвенциональная медицина (от англ. Conventional «обычный, традиционный; общепринятый»).
Некоторые претензии к доказательной медицине.
Макарова О. С. в статье «Официальная медицина»: анализ понятия» (2014) так формулирует проблему:
«Дискурсивное пространство медицинского знания в последние десятилетия значительно расширило свои границы вследствие постоянно растущего объема и сложности медицинских знаний, а также увеличения масштабов оказания населению медицинской помощи и услуг. Это обстоятельство напрямую связано с медикализацией — социальным процессом, в ходе которого происходит распространение влияния медицины на различные сферы общественной жизни».
Светличная Т. Г. и Смирнова Е. А. в статье «Теоретико-концептуальные подходы и результаты эмпирического изучения феномена медикализации (обзор литературы)» (2017) пишут:
«В настоящее время под «медикализацией» понимается «проникновение в массовое сознание медицинского языка и стиля мышления, медицинских концепций и представлений о причинах, формах протекания и лечения болезней, возрастание зависимости от медицины повседневной жизни и деятельности людей, закрепление медицинских «ярлыков» за некоторыми человеческими свойствами или типами поведения».
Также: <…>, в частности, Ханс Баер, Мерилл Зингер и Ида Сассер характеризуют медикализацию как одно из проявлений «биомедицинской гегемонии», навязывающей людям биомедицинские нормы, ценности и представления. Последнее становится возможным благодаря особому статусу научной медицины, основанной на доказательствах. Вследствие этого медицинское экспертное знание пациентами принимается добровольно и не воспринимается как проявление власти. Данное обстоятельство препятствует критическому восприятию медицинского знания как поля власти, как определенной идеологии, которая «воспроизводит неравное распределение власти между социальными классами».
С «официальной» медициной более-менее ознакомились, переходим к «неофициальной».
Неконвенциональная медицина
Неконвенциональная медицина — альтернативная, народная медицина.
Неконвенциональная медицина — условное понятие, объединяющее способы диагностики, предупреждения и лечения болезней человека, которые по тем или иным причинам не получили всеобщего признания у врачей. Основной причиной этого обычно является отсутствие четких правил, большая доля субъективности в выборе и применении данных методов, плохая воспроизводимость результатов в руках разных специалистов и, вследствие этого, сложности в проведении объективных испытаний их эффективности и широкого внедрения в клиническую практику. Существуют определенные трудности и разночтения в терминологии и описании диагностических и терапевтических воздействий в сфере неконвенциональной медицины: народная, традиционная, комплементарная (дополнительная), альтернативная.
В соответствии с позицией ВОЗ, традиционная медицина — это комплексный термин, который относится как к системам народной медицины, таким как традиционная китайская медицина, индийская аюрведа, арабская медицина унани, так и к различным формам медицины коренных народов.
Термин «традиционная медицина», предложенный ВОЗ в 1989 году:
«Набор знаний и практик, поддающихся или неподдающихся толкованию, которые используются в процессе диагностики, профилактики и лечения физического, ментального и социального дисбаланса, и которые опираются исключительно на практический опыт и наблюдения, передаваемые из поколения в поколение устно или письменно». (Цит. по: Традиционная медицина: политика и практика профессионализации /Под ред. Е. Р. Ярской-Смирновой, 2011).
Трактовка Министерства здравоохранения Российской Федерации от 2000 г.:
«Традиционная медицина является совокупностью знаний и навыков, основанных на практике и наблюдениях, передающихся из поколение в поколение в письменной или устной форме, которые могут не иметь научного или логического объяснения, используемых в процессе профилактики, диагностики, лечения заболевания и реабилитации. Традиционная медицина является неотъемлемой частью официальной системы здравоохранения Российской Федерации, и традиционные практики должны быть отнесены к медицинской деятельности». (Цит. по Традиционная медицина: политика и практика профессионализации /Под ред. Е. Р. Ярской-Смирновой, 2011).
Также: «Народная (традиционная) медицина — термин, используемый ВОЗ для определения различных методов оздоровления и лечения, которые существовали задолго до развития и распространения современной научной медицины и продолжают использоваться в настоящее время». (Цит. по Традиционная медицина: политика и практика профессионализации /Под ред. Е. Р. Ярской-Смирновой, 2011).
Также согласно ВОЗ: «Традиционная медицина — накопленные знания, верования и навыки, основанные на теории, убеждениях и опыте коренных народов и представителей различных культур, независимо от того, можем мы их объяснить или нет, которые используются для поддержания здоровья, а также для профилактики, диагностики и улучшения состояния при физических и психических расстройствах». (Цит. по: «Комплементарная медицина: состояние и перспективы правового урегулирования, 2015).
В соответствии с определением ВОЗ: «народная медицина включает в себя различную, связанную со здоровьем практику, подходы, знания и верования, а также медикаментозные средства растительного, животного и/или минеральные по своей природе, спиритуальную, мануальную терапию и упражнения, используемые по отдельности или в сочетании для поддержания благополучия, а также лечения, диагностики и профилактики болезней».
Наряду с термином «народная медицина» в ряде стран для определения широкого набора существующих видов практики в сфере здравоохранения, которые не являются частью собственных традиций страны и не включены в основную систему медико-санитарной помощи, используются термины «комплементарная (дополнительная) и альтернативная медицина».
Комплементарная медицина
Комплементарная медицина (Complementary medicine) — все виды неконвенциональной медицины, используемые в целях здравоохранения совместно с конвенциональной медициной. По предложению Кокрановского содружества комплементарная медицина (КМ) — это диагностика, лечение и/или профилактика, которые дополняют конвенциональную (официальную) медицину, способствуя общим целям сохранения здоровья и удовлетворению спроса, не предоставляемого официальной медициной, или за счет диверсификации официальных рамок медицины.
Комплементарная медицина включает в себя по большей части те направления и практики, которые описаны и исследованы, имеют наработанный практический опыт и традиции, а их действенность подтверждена соответствующей клинической практикой.
Понятие «комплементарная медицина» отличается от альтернативной. В то время как комплементарная медицина используется cовместно с конвенциональной медициной, альтернативная медицина — вместо конвенциональной.
Альтернативная медицина
Альтернативная медицина (нетрадиционная медицина, парамедицина) — собирательное название методов, которые предлагаются для лечения или предотвращения болезней, но не подкреплены научными доказательствами их эффективности и безопасности. Действие методов альтернативной медицины опирается на феномены, существование которых не доказано и часто несовместимо с принципами современной науки. Лечение по методам альтернативной медицины может негативно влиять на здоровье пациентов из-за отказа от клинических методов лечения.
Альтернативная медицина — методы, противостоящие официальной медицине (нередко антинаучные, используемые вместо медицинских средств). Альтернативная медицина — это когда что-то применяется вместо научно обоснованного вмешательства.
К наиболее распространенным альтернативным методам «лечения» относятся: мануальная терапия, массажная терапия, рефлексотерапия, остеопатия, пилатес, йога, хиропрактика, акупунктура (иглоукалывание), акупрессура, прикладная кинезиология, телесно-ориентированные манипулятивные техники, краниосакральная терапия, банки, энергетическая терапия, техника Александера, гомеопатия, бальнеотерапия, психосоматические вмешательства, и многие другие.
С полным списком фуфломицин-методик вы можете ознакомиться в Приложении в конце книги (на основе статьи Василенко А. М. «Комплементарная медицина: вопросы терминологии и классификации», 2014).
Выводы Василенко А. М. подтверждаются Кокрановской классификацией и номенклатурой комплементарных и альтернативных практик (Wieland et al., 2011).
Нетрадиционную медицину называют альтернативной, так как она часто применяется вместо официальной медицины.
Отвечу коллегам по цеху относительно новомодных методов типа подвесных систем и прочего «высокотехнологичного» [а-ля Фродо запутался в паутине и дрыгает ногами]. Если пациент готов за это платить из своего кармана, то — почему бы и нет [без лоха жизнь плоха]. Кинезиотейпирование, слинг-терапия, БОС или проприоцептивное обучение и т. п. — это «развлечение» пациента, пока он выздоравливает естественным путем. Или не выздоравливает, если тяжелая патология. Зарубежные страховые агентства данный вид «вмешательств» не оплачивают, потому что перечисленные методы «реабилитации» не доказали своего превосходства над другими методами реабилитации, демонстрируют скромную «эффективность», сопоставимую с обычными упражнениями, или работают на уровне плацебо. В то же время, Гордон Уоддел (автор биопсихосоциального подхода) писал, что можно применять любой метод лечения, который облегчает боль пациенту, даже если он не доказал своей клинической эффективности. [Главное, чтобы пациент не догадался что он лох и его разводят на бабки]. Так что, если пациент настаивает на применении определенного метода лечения/реабилитации и готов раскошелиться, то какой смысл ему в этом отказывать. [Главное — не брать на себя ответственность, если данный метод не принесет облегчения пациенту].
Чтобы не попасться на удочку мошенников и шарлатанов в белых халатах, читатель должен понимать разницу между альтернативной и комплементарной медициной.
Один и тот же метод лечения, например мануальная терапия, одновременно может быть как альтернативный, читай шарлатанский, так и комплементарный метод лечения, т.е. дополнительный. Но дополнительным он становится только в том случае, если выполняются все предварительные условия протокола обследования, лечения и реабилитации и метод применяется в специализированном учреждении (больница) или профильном центре реабилитации. «Специалисты» отдельно стоящих кабинетиков или ведущие частный прием по квартирам (а это распространенная практика) автоматически попадают в категорию специалистов альтернативной медицины, по-простому — обычные шарлатаны, зарабатывающие деньги на страданиях больного. Данное правило не распространяется на членов одной мультидисциплинарной команды, если они работают удаленно друг от друга (например, психотерапевтам не обязательно работать рядом с залом реабилитации). Реабилитолог может работать у пациента на дому (монореабилитация). Отдельно принимающий массажист, занимающийся заболеваниями позвоночника — вот здесь уже возникают вопросы…
Желание получить мгновенный результат [как реакция на вездесущую рекламу] приводит к тому, что первым делом «страдалец» обращается к альтернативным специалистам, обещающим чудесное исцеление в кратчайшие сроки и за минимальную плату с минимальным использованием фармакологических средств [после собственных неудачных попыток поиграть во врача].
Как бы это не звучало грубо, но зачастую в отделения реабилитации больные поступают не в «девственном» состоянии после травмы или начала заболевания, а уже изрядно потрепанными кем попало с использованием абсолютно «левых» авторских методик. «Поматросил и бросил» — это распространенная практика в этой категории «специалистов». В данной ситуации хуже всего то, что при альтернативных видах лечения теряется драгоценное время для начала адекватной реабилитации. Часто неуспех реабилитации в профильных центрах связан с тем, что пациент до обращения к специалистам уже успел побывать в руках многих альтернативщиков, что привело к слому компенсаторных механизмов, на которые можно было бы изначально опереться и которые выстраивались самим (!) организмом. Очень часто брожение по альтернативщикам сочетается с фармакологическим самолечением, что в разы усугубляет ситуацию. Самостоятельное залечивание — проблема старая… Прекращение боли в спине не говорит о полном выздоровлении. Исчезновение боли всегда наступает раньше, чем происходит полноценное заживление и ремоделирование тканей. Неконтролируемое применение НПВП всегда приводит к ослаблению опорных структур и является предпосылкой к частым рецидивам.
Васильев А. П. и Стрельцова Н. Н. в статье «Кризис современной медицины и возможные пути выхода из него» (2015) привели сводную таблицу различий между западной (читай — ортодоксальной) и восточной (читай — альтернативной) медицинами.

Все «преимущества» восточной медицины нивелируются одной единственной фразой: «невысокий уровень анатомо-физиологических познаний». На обывательском языке это будет звучать так: «Мы не знаем, что болит, почему оно болит и где находиться, но за ваши деньги мы отполируем до блеска ваши чакры и обновим ауру. Если немного доплатите сверху — заодно очистим карму. Вылечить от остеохондроза? — Плевое дело! Ложись на кушетку… сейчас его уберем и заодно исправим осанку».
Все эти заявления о «синтезе, целостном видении и прочем» не более чем пустая и ничем не подкрепленная высокопарная болтовня, далекая от реальной жизни. Обычное заговаривание зубов.
Представителей альтернативных «направлений» предпочтительней называть специалистами альтернативной парамедицины (околомедицины), а не специалистами медицины. По большому счету это не медицина, а квазимедицина (квази — ложный, мнимый, ненастоящий). Здесь объясняется все просто: по мере накопления знаний в разных областях медицины возникают научные направления, в основе которых лежат новые научно обоснованные концепции, в которых переработан и переосмыслен накопленный опыт, сделаны соответствующие выводы, даны новые оценки фактам и представлены новые алгоритмы и подходы к решению определенных задач. Ключевым фактором «новизны» является глубокий анализ и кардинальная переоценка уже существующих знаний с учетом новых открытий в фундаментальной науке. Другими словами, на определенных исторических этапах медицина всегда делает качественный рывок через альтернативный взгляд на решение старых проблем. Потом следует переход в плато и закрепление на данной высоте с обязательной трансляцией знаний на всю популяцию специалистов медицинских направлений. Собственно, профильные учебные учреждения для этого и нужны.
Как пример: «веселящий газ» (закись азота) как полноценная анестезия был предложен британским ученым Гемфри Дэви в 1800 году. Смеялись долго, но не прижилось. Тема наркоза «ожила» только в 1849 благодаря русскому врачу Николаю Пирогову, который проводил операции под эфирным и хлороформным наркозом. До средины 19 века «сложные» переломы конечностей лечили ампутацией. Тот же Пирогов предложил «альтернативное» лечение в виде наложения гипсовой повязки (1855), что стало переломным моментом в ортопедии и спасло конечности многим солдатам на фронте и обывателям Российской империи. Следующий этап — компрессионно-дистракционный аппарат для осуществления соединения и сращения костных переломов Гавриила Илизарова. На момент внедрения все эти методики были «альтернативными».
Другими словами, вспышки «альтернативности» — это нормальное и конструктивное явление, дающее профессиональный рост, поскольку помогают преодолеть застой или заскорузлость мышления. Если «специалист» не владеет элементарными базовыми знаниями по профессии, то он не может физически заявить и отстоять альтернативную точку зрения на решение определенной проблемы. Для внедрения «альтернативной» методики нужны мозги и приличный багаж знаний, а если «специалист» крайне ограничен по уровню профильных знаний — то он простой шарлатан, который пользуется невежеством и внушаемостью своих клиентов. Альтернативность не должна быть синонимом безграмотности, завуалированной неиссякаемым потоком околомедицинского псевдонаучного бреда.
Забегая наперед, сразу отвечу на возможные возражения и недовольство коллег по цеху: мы должны различать коммерческую медицину/реабилитацию и научный вариант медицины/реабилитации, в основном представленный доказательной медициной.
Если мы обратимся к выводам рандомизированных контролируемых исследований, то мы увидим, что все (!) методы реабилитации, которые мы сейчас используем, не подтвердили своей клинической эффективности, если они используются как монометод. Такие виды реабилитации как массаж, мануальная терапия, пилатес рекомендованы к использованию только в том случае, если пациент имел положительный опыт их применения, или верит в эффективность данного метода. В зарубежных клинических руководствах пишут, что это «вторая линия вмешательств». По аналогии: вторая линия вмешательств — это как осетрина второй свежести, а «Свежесть бывает только одна — первая, она же и последняя. А если осетрина второй свежести, то это означает, что она тухлая!» Михаил Булгаков. Мастер и Маргарита). Многие реабилитационные методики протухли уже давно (например, кинезиотейпирование при болях в спине), но мы видим, что этот «товар» все равно крупными партиями поставляется нам из-за рубежа. Оттуда, где этот товар признан неликвидным. И за навязывание подобных «услуг», юристы, представляющие в суде интересы пострадавших пациентов, могут очень сильно спросить. Особенно это относится к тракционной терапии и грубым мануальным вмешательствам. Учитывая коммерческую хватку наших зарубежных «коллег», вполне понятен их подход: зачем что-то выбрасывать, если это можно успешно перепродать лопоухим аборигенам с 300% наценкой. Красиво упаковать, провести рекламную акцию и вперед стричь купоны! Достаточно взглянуть на национальный состав преподавателей различных альтернативных реабилитационных школ, чтобы понять, что «сверхценные специалисты мирового уровня» почему-то зарабатывают себе на хлеб не в странах своего происхождения, а начитывая академические часы студентам [папуасам] — реабилитологам, буквально за копейки налево-направо раздавая бесценные и «засекреченные медицинской мафией» знания с последующей выдачей сертификатов и дипломов из Луна-парка. Широкое распространение получили курсы, на которых заезжий иностранный «специалист» через переводчика чему-то там обучает в своей области. Нужно заплатить от 100 до 250 долларов, два дня прослушать скучные лекции — и вы уже специалист по меридианам/остеопат/акупунктурист/да кто угодно с «сертификатом» международного образца. С иероглифами… это вам не хухры-мухры. Плюс «стопятьсот» к репутации.
Свою деятельность весь этот цыганский остеопатический кочующий по планете табор оправдывает тем, что они обучают интегральной медицине, и что они лечат не болезнь, а всего человека. А, мол, официальная медицина — лечит какой-то конкретный орган или конкретное заболевание. На самом деле, все в точности наоборот. Но маркетинг есть маркетинг: рекламируя свои методы, альтернативщики не гнушаются обливать грязью официальную ортодоксальную медицину. Хотя… Хотя если посмотреть с другой колокольни, то от альтернативных методик также есть польза. В основном, финансовая. Запущенные заболевания лечить однозначно труднее, но зато дольше и с большими затратами для пациента (соответственно выигрывают как фармакологи, так и врачи/реабилитологи за счет увеличения количества платных приемов). И в качестве бонуса — если лечение не пошло или пациент не доволен результатом, то его всегда можно упрекнуть в том, что он сам является причиной неудовлетворительного результата, поскольку: 1) обратился не вовремя; 2) лечился где попало, у кого попало, чем попало и как попало. Сам дурак, мы тут не причем.
Оправдание применения альтернативной медицины звучит примерно так:
Васильев А. П. и Стрельцова Н. Н. в статье «Кризис современной медицины и возможные пути выхода из него» (2015) пишут:
«Медицина нередко лишь пытается помочь пациенту правильно болеть; она не занимается здоровьем, она занимается болезнями.
<…> Довольно показательно то обстоятельство, что, несмотря на успехи в развитии официальной медицины, интерес к народной медицине не только не уменьшается, но и растет. Так, в США 42% пациентов обращаются за услугами неконвенциональной (комплементарной, альтернативной, народной) медицины, 70% населения Канады хотя бы один раз прибегали к использованию таких методов, в Великобритании — 20%. Процентный показатель для населения, обращающегося за услугами нетрадиционной медицины, достигает 75% во Франции, 48% — в Австралии, 38% — в Бельгии. При этом расходы жителей США на альтернативную медицину только за 7 лет возросли с 13 до 38 млрд. долларов в год. Важно отметить, что в России 95% народных целителей не имеют медицинского образования, а 40% из них нуждаются в лечении психических отклонений. Одной из причин представленных фактов, по-видимому, является разочарование в ортодоксальной медицине, оснащенной точными, высокотехнологичными методами диагностики и лечения и имеющей огромный арсенал фармакологических средств, однако не способной оказать реальную эффективную помощь при многих заболеваниях. Миф о всесилии современной медицины несколько потускнел.
<…> Сегодня умереть от лечения столь же реально, как от болезни. Если в условиях прогрессирующей дифференциации медицины различные «узкие» специалисты выявят у пациента «свои» заболевания и одновременно назначат «свое» лечение, то шансов выжить у него практически нет.
Основные проявления кризиса можно свести к нескольким взаимосвязанным положениям:
1. Узкая специализация и все продолжающаяся дифференциация клинической медицины; утрата представлений о целом организме, как объекте познания болезни.
2. Фетишизация лабораторных и инструментальных методов исследования.
3. Фармакологическая направленность.
4. Популяционные тенденции в практической деятельности врача и как следствие деперсонализация пациента.
5. Органо-нозологический принцип медицины, при котором основные усилия направлены на диагностику и лечение конкретной болезни, а не на поиски ее причины и предупреждение».
Довольно забавную статистику предоставили Астафьева Н. Г. и Кобзев Д. Ю. в статье «Между верой и знанием: официальная, альтернативная и комплементарная медицина в лечении астмы и аллергии» (2012):
«Анализ обращений больных аллергическими и иммуноопосредованными заболеваниями в Саратовской области к услугам неконвенциональной медицины показал, что 27% больных обращаются за помощью в храм; к услугам знахарей и народных целителей прибегает 16%; пользуются услугами экстрасенсов — 9%; гомеопатии — 4%, другими формами — 6%.».
Авторы дают такой комментарий: « [раздел] Необоснованное использование альтернативной медицины практиками и потребителями.
По мере развития научной медицины не утратила своего значения псевдонаучная, псевдомедицинская деятельность, направленная на получение выгоды от вводимых в заблуждение людей — шарлатанство, знахарство, мошенничество. Это связано с агрессивной рекламой таких подходов, а также тем, что определенная часть населения в результате собственной интеллектуальной ограниченности, недостаточной информированности, качественно низкого начального и специального образования не может получить и воспринять фундаментальные базовые научные знания. Поэтому они легко откликаются на предложения о снятии «порчи», «очищение кармы», «открытие чакр», улучшение «ауры» и т. д. Формы и проявления псевдонаучных практик в сфере диагностики и лечения могут быть самыми разными в зависимости от бытовых, национальных традиций, уровня культуры и других условий».
Ярская-Смирнова: «Кто обращается к услугам неортодоксальных врачей. Если суммировать характеристики людей, основываясь на частоте упоминаний, то клиент неортодоксальной медицины — это немолодая женщина, разочаровавшаяся в классической медицине, имеющая тяжелое, запущенное заболевание, верящая в возможности комплементарной и альтернативной медицины, от лечения которой отказались традиционные врачи.
А в целом эксперты называли различные характеристики людей, которые обращаются к услугам «народной» медицины: разочаровавшиеся в классической медицине; тяжелые, запущенные случаи; когда отказываются традиционные врачи; те, кто верит в такие практики, доверчивые; любые; с определенным материальным достатком; те, кто ищет нового; подверженные рекламе; с низким уровнем образования; психически неуравновешенные люди; любят систематическое лечение; женщины — больше склонны заботиться о здоровье, лечиться; чем люди старше, тем чаще они обращаются — больше заболеваний с возрастом, больше опасений за состояние здоровья.
Тип заболевания больше влияет на выбор метода лечения, а не на сферу медицины. Так люди, имеющие нервные расстройства, обращаются к иглорефлексотерапевтам, заболевания опорно-двигательного аппарата — мануальным терапевтам. (цит. по: Традиционная медицина: политика и практика профессионализации /Под ред. Е. Р. Ярской-Смирновой, 2011).
На уровне современных научных знаний мы имеем доказательства того, что плацебо не меняет основной биологии болезни, но изменяет реакцию человека на болезнь и ее восприятие.
Башмакова Н. В. и др. в статье «Комплементарная медицина: за и против (взгляд врачей традиционной медицины) (2002) перечисляет риски от альтернативного «лечения»:
<…> «обращаясь к альтернативным методам лечения, пациенты могут столкнуться с неквалифицированными врачами;
· существует риск несвоевременной установки диагноза (пропуск или отсрочка диагноза);
· пациенты могут прекратить или отказаться от эффективного традиционного лечения;
· пациенты могут напрасно тратить деньги на неэффективное лечение;
· обратившийся к альтернативной медицинской помощи пациент может испытать неблагоприятные и даже опасные последствия такого рода лечения;
· Механизм некоторых комплементарных методов терапии настолько неправдоподобен, что они просто не могут работать.
При этом отношение врачей к использованию «неконвенциональной» терапии в конкретных ситуациях непосредственно зависит от того, используются ли они как дополнение или как альтернатива к обычной медицинской помощи, насколько эффективно традиционное лечение в данном случае для этого пациента, насколько вероятно возникновение неблагоприятных последствий».
Вышеописанного вполне достаточно, чтобы иметь общее представление об официальной, комплементарной и альтернативной медицине.
Промежуточные выводы
Достаточно взглянуть на официальное описание двух типов медицины — ортодоксальной и альтернативной, чтобы сразу увидеть кардинальное отличие. Ортодоксальная медицина строится на теоретическом фундаменте, который постоянно перепроверяется научными исследованиями и по мере новых открытий — уточняется и дополняется; устаревшие знания — отбрасываются.
Альтернативная — якобы построена на опыте какого-то народа, не имеет под собой научной базы и, в силу невозможности строгой научной перепроверки, — не имеет своей доказанной эффективности и безопасности.
Отсюда вывод: представитель официальной медицины (врач) легко [при желании] может объяснить этиологию болезни — причины и условия ее возникновения и патогенез — механизм ее возникновения, развития и отдельные проявления течения заболевания. Не всегда может вылечить (это неопровержимый факт), но, по крайней мере, знает о заболевании достаточно много, чтобы критически не усугублять ее течение, как это часто происходит при альтернативном лечении. Врач оперирует фактами и статистикой, поэтому более сдержан в прогнозах исхода лечения и менее склонен к пустым обещаниям «полного исцеления». Исключения из правила есть, но на то они и исключения…
Представители ортодоксальной медицины всегда оперируют официальными определениями заболеваний. Да, на практике в плане коммуникации врачи часто вынужденно «опускаются» до уровня обывателя и оперируют терминами, семантически доступными уму среднестатистического пациента: ВСД, остеохондроз и т. п. Понятно, что речь идет о словесной «двойной бухгалтерии»: два пишем три в уме. Пациенту озвучили одно, в карточку записали «полновесный» диагноз. Альтернативно одаренные «специалисты» или сознательно искажают официальные термины или вообще используют свои собственные. Выдуманные.
Ортодоксальные врачи — это материалисты. Озвученное врачом можно увидеть (МРТ, КТ, УЗИ, ЭНМГ, Доплер и т.п.), точно измерить (лабораторные методы диагностики), выстроить теорию (ретроспективные исследования как источник данных), спрогнозировать результат или подтвердить гипотезу (проспективные исследования). Скукота! То ли дело альтернативные… Они окутаны ореолом таинственности и, как правило, обещают «излечить» заболевания, при которых официальная медицина бессильна.
В официальной медицине патогенез заболевания рассматривается на различных уровнях — от молекулярных изменений, до нарушений в работе организма в целом. При этом выделяют специфические (зависящие от этиологии) и неспецифические (генетически обусловленные) механизмы заболевания. В зависимости от периодов подбирается тип лечения:
Этиотропная терапия направлена на устранение причины заболевания;
Патогенетическая терапия направлена на механизмы развития заболевания;
Симптоматическая (паллиативная) терапия применяется для устранения отдельных симптомов заболевания в дополнение к этиотропной и патогенетической.
Что же касается представителей альтернативной медицины, то об этиологии и патогенезе заболеваний они имеют смутное представление, если имеют вообще какое-либо. Закупорка энергетических каналов, потускнение чакр, меридианы там всякие, фасциальные поезда — это, конечно, все заумно, но это так не работает. Все, что касается доказательной медицины, у альтернативщиков вызывает неадекватные реакции, иногда переходящие в приступы неконтролируемой агрессии. Врачи, промышляющие халтурой или зарабатывающие медицинским лохотроном, всегда будут косо смотреть на доказательную медицину, как и специалисты, оказывающие реабилитационные услуги в области комплементарной медицины.
Пациенты также недолюбливают врачей, которые в своей работе предпочитают опираться на доказательную медицину. Такие врачи, по мнению пациентов, лишают их надежды на чудо исцеления. Правда, речь всегда почему-то идет о внешнем источнике исцеления и пассивной роли самого пациента.
Подтверждая взгляды [и опасения] Светличной, я слегка займусь «медикализацией» и постараюсь сделать так, чтобы в очередной раз «в массовое сознание произошло проникновение медицинского языка и стиля мышления, медицинских концепций и представлений о причинах, формах протекания и лечения болезней», другими словами [Ханс Баер и др.], по мере моих сил и знаний «навяжу людям биомедицинские нормы, ценности и представления», так сказать, слегка «погегемоню» по-биомедицински. И «прикроюсь» я особым статусом научной медицины, основанной на доказательствах.
Часто от пациентов можно слышать жалобы на врачей, что они толком не могут объяснить причину заболевания и как с ней справиться, и почему состояние только ухудшается. Некоторые специалисты вообще ничего не объясняют [потому что руководствуются здравым принципом: «дураки — это интеллектуальное большинство общества» и нет смысла вообще что–либо объяснять, поскольку сказанное будет или неправильно проинтерпретировано или сознательно перекручено]. Или же что разные врачи толкуют все по-своему, часто опровергая сказанное предыдущим врачом и, что их, пациентов, это еще больше запутывает и сбивает с толку… Претензия вполне понятна. Но читатель должен четко уяснить, что многие вещи простыми словами объяснить невозможно в принципе в силу их сложности. Мы не живем в эпоху Средневековья, и многие процессы достаточно хорошо изучены и описаны. Но они описаны научным языком и находу переводить с научного на «язык простолюдинов» — задача сложная, неблагодарная и не под силу большинству специалистов. [А метать бисер перед свиньями — то еще удовольствие].
Кардинальные отличия в представлениях о патогенезе заболеваний проще всего продемонстрировать на примере неспецифических болей в спине. Здесь воочию легко увидеть и понять принципиальную разницу между альтернативной и ортодоксальной медициной [и реабилитацией].
Желающие могут самостоятельно попробовать на пальцах объяснить своим близким/родным/коллегами/да кому угодно то, что я изложу ниже. Я слегка пройдусь по верхам, не вдаваясь в детали и не опускаясь на глубину.
Данная книга — это, в некоторой степени, попытка удовлетворить потребность любознательных пациентов знать причины болей в спине с академической точки зрения через призму реабилитации [поправку на ваши интеллектуальные способности делать я не буду].
Но все по порядку. Сначала — знакомство с основами, потом — в разрезе причин дегенеративных поражений позвоночника, их патогенеза, лечения, профилактики и реабилитации.
Механотрансдукция
Начну с фундамента официальной физической реабилитации на основе медицинских (ортодоксальных) представлений о боли в спине.
Международное название специалистов по физической реабилитации — «Физический терапевт». Не путать с врачебной специальностью «Врач физиотерапевт». С целью избежать путаницы я буду использовать термины «физическая реабилитация» и «специалист по физической реабилитации». «Реабилитологи» после 3-х месячных платных курсов не имеют никакого отношения к специалистам по физической реабилитации. Просто схожее название, вводящее людей в заблуждение.
Физическая реабилитация является частью механотерапии как производной от механобиологии. В основе механотерапии лежит использование механотрансдукции.
Механотрансдукция — это процесс преобразования механических стимулов в клеточный и молекулярный ответ. Другими словами — это механизм, с помощью которого механочувствительные клетки организма реагируют на нагрузку и преобразуют механические стимулы в биохимические клеточные реакции. Поэтому с помощью реабилитационных вмешательств (механических сигналов) через активацию определенных клеточных сигнальных путей возможно напрямую влиять на активацию генов, соответственно на пролиферацию (деление), дифференцировку, жизненный цикл и функционирование клеток.
Механотерапия — это «любое вмешательство, которое использует механические силы с целью изменения молекулярных путей и индукции клеточного ответа, усиливающего рост, моделирование, ремоделирование или восстановление тканей» [определение W.R. Thompson и соавт., 2016].
Почти все клетки организма так или иначе отвечают на механический стимул/стресс. Было идентифицировано множество типов клеток, способных воспринимать механические раздражители и реагировать на них: остеоциты, хондроциты, миобласты, фибробласты, кератиноциты и, что критически важно, — мезенхимальные стволовые клетки. Для реабилитации это имеет первостепенное значение, поскольку после травмы именно адекватная физическая нагрузка будет определять, как будет протекать пролиферация (деление/размножение) клеток и их дифференцировка (или/или/или). В зависимости от силы и длительности стимула будет зависеть, пойдет ли дифференцировка клеток по пути нейрогенеза, адипогенеза, хондрогенеза, миогенеза, фиброгенеза или остеогенеза. При неправильном лечении и реабилитации вместо мышечной ткани часто образуется жировая и фиброзная, вместо костной — хрящевая. Соответственно, с дальнейшим снижением функциональных возможностей поврежденного органа.
К механическим стимулам относятся: растяжение, сжатие, сдвиг, торсия (скручивание), гидростатическое давление, вибрация и движение жидкости параллельно клеточной мембране.
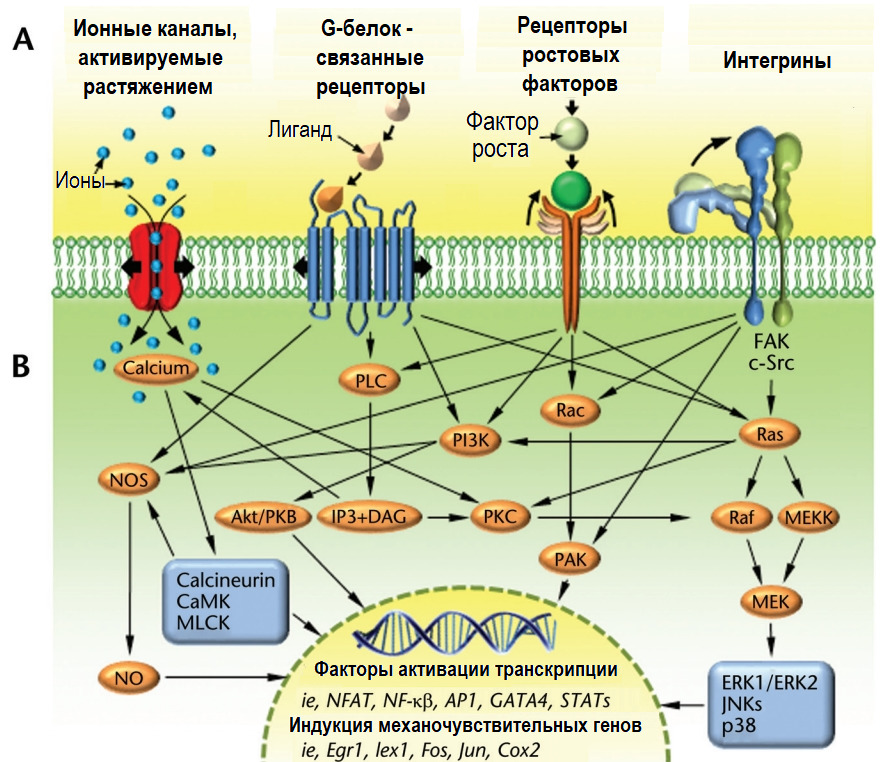
Для «считывания» сигналов в липидных слоях клеточных мембран располагаются различные типы механочувствительных рецепторов: ионные каналы, активируемые растяжением; интегрины; рецепторы факторов роста и рецепторы, связанные с G-белком.
Ионные каналы, активируемые растяжением, представляют собой трансмембранные белки, которые создают в клеточной мембране поры, достаточно большие для пропускания кальция и других катионов при их открытии. Механически вызванное натяжение/деформация мембраны способны открывать каналы, обеспечивая приток и отток ионов через клеточную мембрану в зависимости от внутреннего/внешнего градиента концентрации. Ионный баланс важен для многих клеточных функций и способствует жестко регулируемому электрическому потенциалу клеточной мембраны. Внутриклеточные концентрации кальция регулируют внутриклеточную передачу сигналов, полимеризацию актина (внутриклеточный механический сигналинг), ремоделирование цитоскелета и подвижность клеток.
Рецепторы, связанные с G-белком (GPCR), представляют собой крупные белки с 7 трансмембранными доменами. Внеклеточная часть связывает многие эффекторные белки и молекулы, такие как факторы роста, воспалительные цитокины, нейропептиды и гормоны, создавая конформационные изменения в структуре белка. После активации цитозольная (внутренняя) часть рецептора взаимодействует с внутриклеточными G-белками, воздействуя на сигнальный каскад в соответствии со специфичностью сигнала. Эти рецепторы также могут активироваться механическими нагрузками на поверхности клетки, которые инициируют каскады вторичных мессенджеров внутри клетки.
Рецепторы факторов роста активируются путем связывания с внеклеточными факторами роста, которые, в свою очередь, дополнительно активируют несколько опосредованных путей вторичных мессенджеров внутри клетки. Рецепторы факторов роста перекрестно связаны с другими механочувствительными рецепторами клеточной мембраны и могут усиливать их сигнальные эффекты.
Интегрины управляют клеточным сигналингом посредством актино-миозиновых связей между экстраклеточным матриксом, базальной (плазматической) мембраной и мембранными рецепторами ядра клетки.
Мембранные механочувствительные рецепторы могут воспринимать как механические, так и биохимические сигналы (гормоны, цитокины, ростовые факторы и пр.).
Механический сигнал передается по оси «матрикс — рецепторы/интегрины — цитоскелет — ядро».
Активированный рецептор на поверхности клеточной мембраны посредством последующей активации цитозольных медиаторов «каскадно» вовлекает в биохимическую реакцию транскрипционные факторы (исполнители команд), которые смещаются в ядро клетки, «включают» экспрессию генов, и, таким образом, запускают процесс синтеза необходимых аминокислот с последующей их сборкой в активные белки.
Итак. Трансформация внешнего сигнала (химического, электрического или механического) в клеточный ответ производится за счет «сигналинга» — последовательных биохимических реакций внутри клетки. Большинство транскрипционных ответов на нагрузки опосредуются через каскады вторичных мессенджеров и могут создавать длительные биологические эффекты. Клетка «запоминает» команды и «обучается» реакции на стимул.
Поскольку существует множество различных механочувствительных рецепторов, также существует множество сигнальных путей, которые клетка использует для генерации биохимического ответа.
Перечислю основные «сигнальные пути» и их краткую характеристику. Это понадобиться для понимания причин заболевания позвоночника, роли профилактики и реабилитации, а также влияет на выбор препаратов при лечении и для профилактики.
Сигнальные пути
Для удобства клеточный «сигналинг» буду описывать с поправкой на клетки скелетно-мышечной (опорно-двигательной) системы. Свое название сигнальные пути получили по названию ведущего белка или процесса.
Сигнальный путь Аденозинмонофосфат (АМФ) -активированной протеинкиназы (АМРК). АМФК — фермент, действующий как «энергетический сенсор», регулирующий энергетический гомеостаз при понижении уровня клеточного аденозинтрифосфата (АТФ). Участвует в катаболических и анаболических процессах на молекулярном и клеточном уровнях. Влияет на регуляцию аппетита в гипоталамусе.
[Далее: протеинкиназы — это большая группа ферментов, которые катализирует перенос концевого остатка фосфата с АТФ на различные группы в структуре белка; по сути — активаторы биохимических реакций].
В ходе реакции, катализируемой протеинкиназами, нейтральная спиртовая группа белка превращается в сложный эфир, несущий большой отрицательный заряд. Это приводит к значительным изменениям в структуре белка, сопровождается его структурными перестройками и изменением свойств. Химическая модификация молекулы белка, происходящая под действием протеинкиназ, является эффективным способом регуляции активности многих ферментов и других внутриклеточных белков. Остаток фосфорной кислоты, перенесенный протеинкиназой на спиртовую группу белка, может быть удален под действием другого фермента — фосфатазы. Таким образом, протеинкиназы и фосфатазы образуют две группы ферментов-антагонистов, способных осуществлять обратимую модификацию белков-мишеней и тем самым регулировать их активность].
Сигнальный путь Wnt/β-катенин (Wnt wingless-type signaling pathway) — филогенетически древний механизм регуляции развития и поддержания гомеостаза тканей за счет контроля пролиферации (деления), дифференцировки стволовых клеток, миграции и апоптоза (запрограммированной смерти клеток). Активный участник процессов регенерации, роста костей, и массы других процессов, связанных с морфогенезом и определением клеточной судьбы. Катаболический путь для хрящевой ткани (для диска).
Сигнальный путь Ядерного фактора «каппа-би» [официально: транскрипционный фактор NF-κB; англ. nuclear factor kappa-light-chain-enhancer of activated B cells]; центральный компонент клеточного ответа на повреждение, стресс или воспаление. Мастер — регулятор катаболических и воспалительных реакций клеток: функционирует как один из важнейших быстродействующих внутриклеточных мессенджеров, соединяющий самые разнообразные сигналы окружающей среды с последующей экспрессией многочисленных генов. NF-κB оперативно регулирует различные биологические процессы, начиная от роста клеток, их выживания до развития тканей и органов. Играет ведущую роль в патогенезе многих хронических воспалительных процессов. NF-κB регулирует многие гены, участвующие в кодировании цитокинов, хемокинов, белков острой фазы, молекул адгезии, индуцибельных эффекторов ферментов (например, циклооксигеназы-2 (ЦОГ- 2; СОХ-2), таким образом являясь активатором иммунных и воспалительных реакций. NF-κB является центральным звеном активации генов, кодирующих регуляторы апоптоза и клеточной пролиферации.
Применительно к болям в спине: активация NF-κB повышает синтез матриксных металлопротеиназ (ММР -1, 3, 13) и аггреканаз (ADAMTS 4,5) в хондроцитах хрящей суставов и хондроцитоподобных клетках диска в ответ на механический стимул (компрессия), тканевую гипоксию, оксидативный стресс, продукты гликации, клеточный детрит («мусор»), ацидоз (снижение pH диска).
Матриксные металлопротеиназы (Matrix metalloproteinases; ММР) — основные протеолитические энзимы в организме, разрушающие белковые структуры (матрикс тканей). Их синтез приводит к «расплавлению» матрикса диска или хрящевых поверхностей суставов.
Аггреканазы (A Disintegrin and Metalloproteinase with Thrombospondin motifs; ADAMTS) — основные протеолитические энзимы, разрушающие аггреканы, белковые комплексы, удерживающие воду в тканях.
Сигнальный путь Митоген — активируемой протеинкиназы (MAPK) — нечто среднее между NF-κB и Wnt/β-катенин сигналингом: клеточный ответ будет зависеть от стимула.
В «семью» MAPK входят ERK, p38MAPK и JNK. Экстраклеточный-сигнал регулируемая киназа (ERK) активируется митогенами, ростовыми факторами, трансформирующими факторами роста, факторами роста фибробластов и инсулиноподобным фактором роста, таким образом регулируя рост клеток, их дифференциацию, развитие и жизненный цикл. Сигналинг ERK поддерживает выживаемость клеток при гипоксии и перепадах осмотического давления. Механочувствительный (активируется интегринами). При активации провоспалительными цитокинами фактором некроза опухоли-альфа (ФНО- α; TNF-α) и интерлейкином -1 бета (ИЛ-1β; IL-1β) поддерживает воспаление.
p38MAPK — стресс-активируемый путь, регулирующий воспаление, апоптоз, дифференциацию клеток. Активируется гипоксией, гиперосмолярностью, механической нагрузкой, эндоплазматическим стрессом, ацидозом, высоким уровнем глюкозы и провоспалительными цитокинами.
JNK (янускиназный) путь чем-то схож с p38MAPK, только он «легок на подъем» при активации пропионовыми бактериями и легко запускает апоптоз. Активация JNK приводит к повреждению ДНК, повышению синтеза матриксных металлопротеиназ, активации Toll — подобных рецепторов 2 типа (ниже в тексте), индукции синтеза «белка старения» р53. Принимает активное участие в дегенерации дисков.
Суммарно NF-κB и MAPK пути определяют активацию генов, которые регулируют синтез матрикс деградирующих энзимов (ADAMTS 4,5, ММР — 1, 2,3,9, 13, 14) и их антагонистов — тканевых ингибиторов матриксных протеиназ (TIMP-1, 2); матриксных протеинов (аггрекана, коллагена I и II типа), регулируют синтез простагландинов (через ЦОГ — 2); цитокинов ИЛ-6 (IL-6), ИЛ — 8 (IL-8); ростовых факторов IGF-1 и TGF — beta1; транскрипционного фактора SOX-9 (влияет на Wnt сигналинг хондроцитов); синтез оксида азота и многое другое.
При этом активация ядерного фактора «каппа би» (NF-κB) помимо выработки провоспалительных цитокинов (IL-1β, TNF-α, IL-6 и др.), в малых количествах вызывает преждевременное «старение» клеток со сменой их фенотипа, в большом количестве — приводит к смерти клеток (апоптозу — «запрограммированной», но часто преждевременной, или к пироптозу — преждевременной смерти вследствие критического повреждения самой клетки). В любом случае, гиперактивация данного транскрипционного фактора не сулит ничего хорошего ни для самой клетки, ни для окружающего ее матрикса, ни для ткани, ни для органа.
Нарушение регулировки сигнальных механизмов, основой которых является NF-κB и MAPK сигналинг, связано со многими тяжелыми болезнями человека, такими как рак, аутоиммунные заболевания, хронические воспаления, нарушение обмена веществ, диабет обоих типов, нейродегенеративные болезни, ревматоидный артрит, остеоартриты, дегенеративная болезнь диска и прочее.
Hedgehog («ежовый») сигналинг — критическая роль в формировании костей: отвечает за дифференцировку остеобластов, хондрогенез, формирование хрящей. Hedgehog (тип Sonic) стимулирует формирование остеокластов и препятствует сращению костей. Участвует в прогрессировании возраст-зависимых заболеваний (сердечно-сосудистые заболевания, старение кожи).
FOX0 (Forkhead box) — катаболический путь для мышц и хрящевой ткани.
NOTCH — регулирует гомеостаз костей. «Ишемический» (зависящий от кровоснабжения) сигнальный путь, завязанный на парциальном напряжении кислорода. Подавляет апоптоз в клетках пульпозного ядра и фиброзного кольца после активации их фактором некроза опухоли-альфа или при гипоксии. Сигнальный путь NOTCH пересекается с NF-κB, MAPK, PI3/AKT и Wnt/β-катениновым путями, влияя на их сигналинг.
Rhoa/ROCK (Ras homolog family member A/Rho-associated protein kinase 1 (ROCK)) — механический путь, активируемый интегринами. Пересекается с Wnt/β-катенин сигнальным путем. Регулирует синтез генов L-Sox-5, Sox-6 и Sox -9, от которых зависит синтез коллагенов I и II типов — основного материала матрикса связочной и хрящевой ткани.
TGF/BMP (путь трансформирующих ростовых факторов/костных морфогенных протеинов) — регуляция роста кости через контроль дифференцировки остеобластов. BMP регулируется миокином Ирисином через интегрины. Снижение BMP сигналинга связано с возрастным остеопорозом.
FGF (фактор роста фибробластов) сигналинг — развитие скелета и дифференцировка фибробластов: стимуляция пролиферации предшественников остеобластов (самообновление костей), регулирует гомеостаз фосфатов, метаболизм витамина D, пересекается с сигнальными путями Wnt и p53/p21 (сигнальный путь старения клеток), которые вовлечены в патофизиологию остеопороза и кальцификации сосудов. Взаимодействует с сигнальными путями MAPK и PI3/AKT, опосредовано изменяя их сигналинг.
Сигнальный путь PI3/AKT/mTORC1. (Фосфоинозитид-3 киназа/протеинкиназа В/механическая цель рапамицина). На данном сигнальном пути держится вся физическая реабилитация. В зависимости от типа сигнала данный путь активирует или анаболические гены, или катаболические. Данный путь пересекается с NF-κB и MAPK путями и напрямую подавляет их активность при условии анаболической стимуляции.
PI3/AKT — анаболический путь для хрящевой и связочной ткани. mTORC1 — мастер-регулятор мышечного анаболизма. Если сигнальный путь Wnt/β-катенин специализируется на метаболизме костей, то PI3/AKT/mTORC1 — это метаболизм мягких тканей опорно-двигательной системы.
Существует множество других сигнальных путей, клеточных мессенджеров и транскрипционных факторов активации генов с последующим развитием внутриклеточных, экстраклеточных и тканевых/внутриорганных событий.
Многие из сигнальных путей перекрываются и «переплетаются» между собой, зачастую используя общие сигнальные молекулы/мессенджеры (цитозольные медиаторы). Грубо говоря, сигнальные пути можно сравнить с химическими «дорогами» с их перекрестками и развилками.
Мембранные рецепторы взаимодействуют друг с другом через адапторные белки, при этом сигналы с рецепторов распространяются по различным путям, одновременно активируя различные типы сигнальных мессенджеров/посредников, создавая перекрестные помехи между внутриклеточными сигнальными каскадами. Механические и химические механизмы передачи сигнала стимулируют одни и те же внутриклеточные сигнальные пути (ни один из них не работает изолированно от другого), при этом вызывая синергетические и конкурирующие эффекты, направленные либо на усиление, либо на подавление генетического ответа.
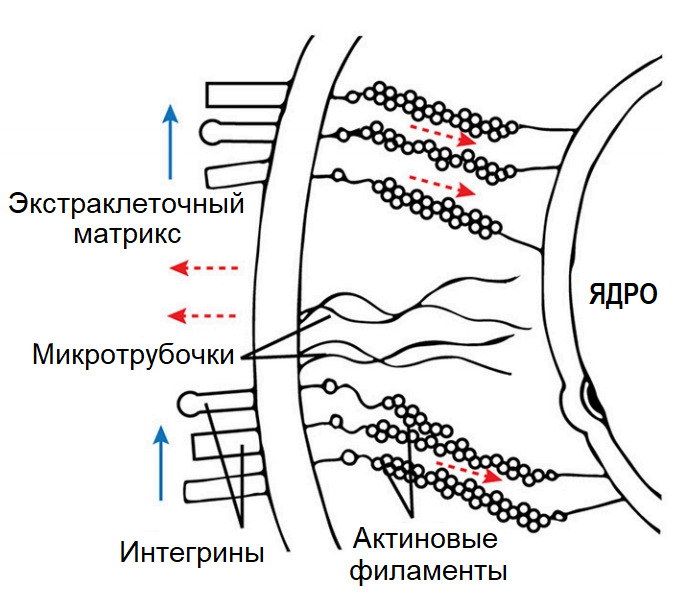
Механический сигнал через интегрины может передаваться напрямую через систему белковых нитей, соединяющих экстраклеточный матрикс с мембраной клетки, и нитей «цитоскелета», пронизывающих внутриклеточный цитозоль и ведущих напрямую к оболочке ядра. Задействован принцип «вожжей». Это дает выигрыш в скорости биохимической реакции клетки на внешние стимулы. Таким образом, механические нагрузки влияют на транскрипцию генов опосредованно через активируемые рецепторами сигнальные каскады и напрямую через изменение транспорта ядерной мембраны. Поэтому клетку можно представить как компьютер, который суммирует все внешние механические, химические и электрические сигналы и вычисляет, какой ответ в итоге будет выдан в «сборочный цех» клетки: анаболический или катаболический. Синтезированные в результате реакции клетки функциональные белки являются основными факторами в текущем поведении клетки (интракринное/аутокринное влияние) и определяют ее дальнейшую судьбу. Клетка может ответить синтезом структурных белков, используемых для ремоделирования матрикса, или выдать провоспалительный ответ в виде синтеза цитокинов и протеиназ, разрушающих матрикс, или сменить фенотип (мгновенно «постареть»), или активировать режим самоуничтожения (запланированный — апоптоз, или вынужденный вследствие повреждения мембраны — пироптоз и т.п.).
Таким образом, дифференцировка, рост, жизненный цикл и гибель клеток регулируются и всецело зависят от внешних стимулов и внутриклеточных сигнальных каскадов, влияющих на генетическую регуляцию.
Механические силы, такие как растяжение, сжатие и сдвиг, воспринимаются и передаются на границах раздела «клетка-клетка», «клетка-матрикс» и «клетка-межклеточный просвет», создавая реакции, которые могут либо усилить структуры, подвергающиеся механическому воздействию, либо изменить фенотип или структуру клеток и в дальнейшем привести к дистрофии или деградации/дегенерации тканей вследствие гибели клеток.
Посредством молекул клеточной адгезии (слипания) клетки также оказывают прямое механическое влияние на соседние клетки. Эти молекулы включают трансмембранные белки, такие как интегрины, кадгерины, селектины и коннексины, которые связывают клетки вместе для структурных и функциональных целей. Соединения между клетками очень напоминают клеточные матричные комплексы с динамическими связями с цитоскелетом, которые реагируют на механическую нагрузку. Эти контакты влияют на «коллективное» поведение клеток, включая адгезию, миграцию, изменение формы, пролиферацию, дифференцировку стволовых клеток, передачу внутриклеточных сигналов и обмен матрикса.
Перекрестная коммуникация между клетками, внутритканево и на системном (органном) уровне осуществляется с помощью химического «языка» — активных белковых и небелковых соединений — органокинов: цитоконов, хемокинов, активных форм кислорода и т. д. Клетки каждой ткани синтезируют свои специфические мессенджеры, воспринимаемые другими клетками организма как своеобразные команды или послания с соответствующим последующим «ответом» на них. Соответственно, мышечная ткань синтезирует миокины, костная ткань — остеокины, жировая — адипокины, иммунная — цитокины, печень — гепатокины и т. п.
Различные клеточные «-кины» воздействие могут осуществлять аутокринно — действие на саму клетку-продуцента; паракринно — на близкорасположенные клетки и ткани; эндокринно — дистантно на другие органы.
Экзеркины и миокины
Начну с мышц, как «катализатора» обменных и репаративных процессов и самой «понятной» [на уровне шашлыков и куриных ножек] ткани организма.
Обыватели, в основной своей массе, рассматривают мышцы как орган, приводящий в движение рычаги скелета с целью выполнения определенной работы и служащие для поддержания тела/позы в гравитационном поле Земли. Также как орган, выполняющий вспомогательную насосную функцию, облегчающую микроциркуляцию крови в организме. Знают про участие в дыхании (диафрагма). Кто-то что-то слышал про участие в термогенезе. Как правило — и все… на этом познания и заканчиваются. Фундаментальная наука и клиническая медицина рассматривает мышечную систему в более широком аспекте/формате: помимо вышеперечисленных общеизвестных функций, учитывается и влияние мышечной ткани как самого крупного неспецифического эндокринного органа на обменные процессы всего организма. В общей сложности на данный момент установлено порядка 650 видов мышечных цитокинов (миокинов), вырабатываемых при мышечном сокращении/растяжении мышц. У человека описаны около 300. И если учитывать, что мышечная ткань у взрослого человека составляет порядка 40—60% от общей массы тела, то вклад миокинов в поддержание гомеостаза и здоровья человека просто колоссальный. Миокины действуют аутокринно, паракринно — например, мышца на кость, к которой прикрепляется и эндокринно — через кровь на мозг/печень/почки и т. д.
Чтобы было понятно, о чем идет речь, перечислю некоторые молекулярные соединения, которые синтезируются и выбрасываются в кровь при мышечной работе:
Цитокины и факторы роста:
Костный морфогенетический белок 1, 4
Нейротрофический фактор мозга
Гранулоцитарный колониестимулирующий фактор
Инсулиноподобный фактор роста 1, 1А, 2
Белки, связывающие инсулиноподобный фактор роста 2,
3, 4, 5, 6, 7
Интерлейкин 1β, 2, 4, 6, 7, 8, 10, 13, 17А, 25, 34
Макрофагальный колониестимулирующий фактор 1
Остеокластстимулирующий фактор 1
Тромбоцитарный фактор роста А, С
Секретируемый белок, связанный с frizzled 2, 4
Фактор стромальных клеток 1 (C-X-C мотив хемокин 12), 2
Трансформирующий фактор роста β (1,2,3)
Фактор некроза опухоли α
Фактор роста эндотелия сосудов A, C, D
и др.
Белки внеклеточного матрикса:
Гепарансульфат базальной мембраны
Белок ядра протеогликана (Perlecan)
Бигликан
Коллаген I (α1, α2), II (α1) и др.
Декорин
Фибриллин 1, 2
Фибулин 1, 2, 5, 7
Матриксный Gla протеин
Мимекан (остеоглицин)
Периостин
Протеогликан 4
Фактор фон Виллебранда типа А, эпидермальный фактор
роста и пентраксин доменсодержащий белок 1 (SVEP1)
и др.
Энзимы:
Ферменты матриксной металлопротеиназы 2, 9, 14, 19
Супероксиддисмутаза
Активатор плазминогена тканевого типа
И прочее:
Семафорины 3 (А, Б, В, D, Е), 4 (В, С), 5А, 6 (А, В), 7А
Рецептор эфрина типа А 1, 2, 4, 7
Экзостозин 1, 2
Белок 1 WNT1- индуцируемого сигнального пути
и др.
Биохимики и лаборанты с легкостью расширят список.
С точки зрения физической реабилитации полноценное восстановление тканей (соответственно и функции) требует меньше медикаментов и больше адекватной двигательной активности, поскольку репарация и ремоделирование поврежденной ткани всецело зависит от гомеостаза окружающих тканей, который в свою очередь зависит от общего миокинового и цитокинового фона; по-старому — от гуморального фактора мышечной работы (Голдштейн, 1961); по-новому — от синтеза «экзеркинов». Другими словами — физическая реабилитация влияет на ткани через прямую активацию/влияние на сигнальные пути. Баланс миокинов, остеокинов, адипокинов и других цитокинов во многом определяют общий гомеостаз организма и предрасположенность к заболеваниям. Миокины запускают или тормозят различные биохимические процессы в клетках, тем самым стимулируя и поддерживая полноценную работоспособность всего организма. Действия многих миокинов хорошо изучены и систематизированы.
Общие функции миокинов
Контроль механизма восстановления тканей
Контроль над воспалительным каскадом
Влияние на механизм клеточной адгезии
Анатомо-структурное развитие организма
Регуляция ангиогенеза
Влияние на иммунный ответ хозяина
Контроль секреции инсулина
Пролиферация и миграция сателлитных клеток
Организация внеклеточного матрикса
Ремоделирование внеклеточного (экстраклеточного) матрикса
Положительная регуляция локомоции
Модуляция дегрануляции тромбоцитов
Регуляция окисления жирных кислот
Противоопухолевый защитный механизм
Ниже дана краткая характеристика основных активных веществ, синтезируемых при мышечном сокращении, и описана их роль в поддержании гомеостаза организма. Привожу оригинальные названия синтезируемых «веществ», упоминаемых в медицинской и реабилитационной литературе.
PGC-1α — коактиватор 1-альфа гамма (γ) — рецептора-активатора пролиферации пероксисом.
Свое название получил по первой открытой функции — первоначально PGC-1α был обнаружен в бурой жировой ткани как белок, взаимодействующий с PPAR γ и участвующий в адаптации термогенеза в ответ на холод.
Ключевыми регуляторами обмена липидов являются пероксисомы — это клеточные структуры, участвующие в окислении жирных кислот, синтезе липидов, холестерина, обезвреживающие токсичные вещества, а также выполняющие множество других функций.
Нарушение обмена липидов (избыток свободных жирных кислот в крови и накопление метаболически активной жировой ткани в брюшной полости и других органах) являются источником хронического неконтролируемого системного низкоуровневого (низкогредиентного) воспаления, которое может стать причиной развития различного рода хронических заболеваний (атеросклероз, артериальная гипертензия, сахарный диабет 2-го типа и т.п.).
Пероксисомы активируются специфическими рецепторами (Peroxisome proliferator-activated receptor (PPAR) при помощи транскрипционных коактиваторов PGC-1. Рецепторные белки (PPAR) служат так называемыми липидными датчиками организма, при активации которых изменяется метаболизм углеводов и липидов. Также белки PPAR являются транскрипционными факторами, т.е. белками, регулирующими экспрессию целого ряда генов, участвующих в обмене углеводов и липидов, в воспалительных и других процессах, протекающих в организме.
Поскольку метаболизм и обменные процессы в организме во многом зависят от физической нагрузки, то вполне очевидно, что именно самая активная метаболическая ткань будет задавать основной тон в данных процессах. Как раз синтез коактиватора PGC-1α при мышечной работе и будет во многом определять метаболический профиль клеток организма.
Экспрессия и активность коактиватора-1α (PGC-1α) жестко контролируются несколькими сигнальными путями, которые объединяют эндокринные события и биоэнергетические состояния. Сигналы окружающей среды, такие как воздействие холода, физические упражнения, качество и объем питания и другие «метаболические» стрессы, активируют эти сигнальные пути через катехоламины, глюкокортикоиды, глюкагон и цитокины. Клеточный энергетический стресс также активирует передачу сигналов путем изменения синтеза аденозинтрифосфата (АТФ), кислорода, активных форм кислорода (АФК) и уровня цитоплазматического Ca2+.
PGC-1α — обеспечивает прямую связь между внешними физиологическими стимулами и регуляцией митохондриального биогенеза. Является мастер-регулятором энергетического обмена. Различные типы (изоформы) PGC-1α координируют окислительный метаболизм и активируют широкую тканенезависимую программу экспрессии генов, которая управляет митохондриальным биогенезом и усиливает клеточное дыхание (регуляция синтеза транспортных белков, которые доставляют топливо в митохондрии, и антиоксидантных белков, которые нейтрализуют кислородные радикалы, образующиеся при усиленном оксидативном дыхании и пр.).
Регулярные физические упражнения стимулируют выработку PGC-1α в скелетных мышцах, что позволяет им адаптироваться к окислительному (оксидативному) стрессу, таким образом предотвращая преждевременную гибель клеток из-за повреждений митохондрий. Взаимодействуя с ядерным рецептором PPAR-гамма, определяет дальнейшее взаимодействие этого белка со многими факторами транскрипции, отвечающими за выживаемость клетки.
PGC-1α является основным фактором, который регулирует детерминацию типа мышечных волокон. Синтез PGC-1α индуцируется упражнениями на выносливость. PGC-1α регулирует метаболизм лактата, предотвращая повышение его уровня при упражнениях на выносливость; делает лактат более эффективным источником энергии.
Синтез PGC-1α стимулируется холодовым воздействием, что влияет на адаптивный термогенезом через секрецию β-аминоизомасляной кислоты при тренировке мышц.
PGC-1α ингибирует активность NF-κB — основного провоспалительного сигнального пути, подавляя продукцию провоспалительных цитокинов.
PGC-1α (изоформа 4) блокирует сигнальный каскад, активируемый Миостатином, предотвращая распад мышечных структурных белков, одновременно стимулируя гипертрофию волокон за счет воздействия на передачу сигналов инсулиноподобного фактора роста-1 (IGF1).
PGC-1α принимает участие в поляризациию макрофагов во 2 тип — противовоспалительный, таким образом, являясь модулятором иммунного ответа, что указывает на его роль в заживлении и репарации тканей. В скелетных мышцах PGC-1α вызывает секрецию факторов, которые модулируют активность резидентных иммунных клеток.
Секретируемые факторы, контролируемые PGC-1α, участвуют в системной коммуникации и влияют на обучение и поведение через передачу сигналов ирисина и кинуренина в мозге.
Физические упражнения в сочетании с ограничением калорийности пищи через коактиватор-1α (PGC-1α) приводят к: повышению синтеза гликогена, повышению транспорта и усилению окисления жирных кислот, повышению захвата глюкозы клетками, повышению митохондриального биогенеза, повышению ремоделирования и устранению повреждений в митохондриях, повышению липогенеза, повышению аутофагии, повышению синтеза цитокинов, отвечающих за ангиогенез, повышению способности к переключению типов мышечных волокон под воздействием физической нагрузки, повышению транскрипции и индукции генов, отвечающих за выживаемость клетки, повышению секреции миокинов, снижению синтеза провоспалительных цитокинов, управляет генами, ответственными за формирование синапсов (мест контакта нервного волокна и миофибриллы). В итоге действие PGC-1α суммарно повышает капилляризацию мышц, повышает физическую выносливость, мышечную окислительную мощность (дыхательную мощность), снижает мышечную дистрофию, предотвращает развитие атрофии, влияет на толерантность к инсулину, препятствует развитию старческой саркопении, поддерживает работоспособность нервно-мышечных синапсов, компенсирует митохондриальную дисфункцию и подавляет низкогредиентное системное воспаление.
Регулярная аэробная физическая активность приводит к повышению синтеза ядерного фактора, связанного с фактором эритроидного происхождения-2 (Nrf2). Данный фактор необходим для адаптации к физическим нагрузкам и обеспечивает защиту от повреждения скелетных мышц, вызванного оксидативным стрессом. Фактор (Nrf2) управляет программами транскрипции «антиоксидантных» генов, регулируя клеточную защиту от воздействия токсичных веществ и окислителей, таким образом препятствуя повреждению ДНК. Оказывает положительное влияние на мышцы, индуцируя биогенез и функцию митохондрий.
Миокины и остеокины, так называемые экзеркины (походное от английского глагола «to exert» — напрягаться, прилагать усилия).
Приведены функции наиболее важных (скорее хорошо изученных) миокинов и остеокинов, участвующих в перекрестном взаимодействии мышц и костей, и их влияние на общий метаболизм.
Интерлейкин — 6 (IL-6). Первый миокин, который выбрасывается в кровь при мышечной работе. Открыт в 1980 году. Цитокин с крутым нравом. Деструктивный, но с положительными свойствами. «Свой среди чужих, чужой среди своих». Свойства данного цитокина определяются источником его происхождения. Мышечный IL-6 (как миокин) крайне полезный и определяет весь метаболизм при физической нагрузке и восстановлении. Миокин мышечного гомеостаза. Если синтезируется клетками иммунной системы (моноцитами, макрофагами и др.) — IL-6 — третий в списке по крутости провоспалительный цитокин (после фактора некроза опухоли-альфа (TNF-α) и интерлейкина-1 бета (IL-1β)). После интенсивной физической нагрузки содержание мышечного IL-6 в плазме может возрастать в 100 раз (уровень растет по экспоненте), при этом постоянные тренировки/физическая активность поддерживают низкий базальный уровень данного миокина, если он вырабатывается мышцами непосредственно во время физической работы без первичной активации фактором некроза опухоли (при воспалении, например). «Острый» физнагрузочный IL-6 усиливает чувствительность к глюкозе и увеличивает ее поглощение, усиливает окисление жирных кислот, обеспечивая энергетическим субстратом работающие мышцы во время физической нагрузки. Стимулирует синтез инсулина бета-клетками, положительно влияет на их пролиферацию и защищает от апоптоза.
Как цитокин, IL-6 также может синтезироваться и жировой тканью (адипоцитами). У малоподвижных людей высокий уровень циркулирующего плазменного IL-6 положительно связан с развитием ожирения и инсулинорезистентностью. IL-6 ингибирует экспрессию субстрата рецептора инсулина 1 (IRS1) и транспортера глюкозы 4 типа (GLUT4) в адипоцитах (здравствуй диабет 2 типа!). Жировая ткань может обеспечить до 35% циркулирующего провоспалительного IL-6, что определяет его роль в хроническом низкогредиентном воспалении.
Участвует в регуляции иммунного ответа на повреждение тканей: при «острых» выбросах реализует свои противовоспалительные эффекты через подавление фактора некроза опухоли-альфа и интерлейкина-1бета — главных провоспалительных цитокинов. Через активацию синтеза IL-10 — главного противовоспалительного цитокина, влияет на поляризацию макрофагов во 2 тип — противовоспалительный/репаративный. Мышечный IL-6 подавляет действие главного воспалительного цитокина интерлейкина 1-бета (IL-1β) через стимуляцию синтеза антагониста его рецептора (IL-1Ra).
Хронический «выброс» жирового и/или иммунного IL-6, наоборот, усиливает действие фактора некроза опухоли — альфа (TNF-α) и интерлейкина 1-бета (IL-1β), являясь, таким образом, причиной хронизации заболеваний.
Как цитокин стимулирует оборот костной ткани путем регулирования резорбции кости и выработки остеокальцина и RANKL. Усиливает катаболизм мышечных белков в мышцах с высоким содержанием «жирового» IL-6 (неработающие мышцы), таким образом, являясь синергистом миостатина в плане развития саркопении. «Мышечный» нагрузочный IL-6 стимулирует мультипликацию сателлитных клеток в мышечной ткани, способствуя гипертрофии мышц.
Вместе с адреналином мышечный IL-6 мобилизируют и активируют специфические типы клеток натуральных киллеров (NK), которые подавляют рост раковых клеток.
Таким образом, «острый» мышечный IL-6 — хорошо; «хронический» жировой и/или иммунный — очень плохо.
Миостатин (Myostatin) — миокин гиподинамии — вырабатывается мышечными клетками и активно секретируется в кровь. Приводит к снижению роста мышечной ткани путем подавления пролиферации, дифференцировки миоцитов и синтеза белка. Негативно регулирует объем мышц: при низком уровне миостатина возникает выраженная гипертрофия; при высоком синтезе миостатина — атрофия и саркопения вследствие распада мышечных белков. Повышает степень рекрутирования и дифференцировки остеокластов, что приводит к резорбции костей за счет усиления остеокластогенеза и препятствия остеобластогенеза (костеобразования).
Оказывает системное воздействие на организм через нарушение углеводного обмена. Способствует адипогенезу (отложению жиров). Также может синтезироваться жировой тканью.
Синтез миостатина усиливается при лечении с использованием глюкокортикоидов, что вызывает ятрогенную потерю мышечной массы.
[Сама по себе мышечная ткань потребляет большое количество энергии, поэтому миостатин препятствует излишнему накоплению неиспользуемой по назначению мышечной массы].
Декорин (Decorin) — антагонист миостатина (прямое блокирование); секретируется миоцитами и высвобождается в кровь во время мышечного сокращения. Усиливает выработку основного антагониста миостатина — фоллистатина. Ускоряет заживление мышечной ткани и препятствует фиброзу мышц. Подавляет ангиогенез и онкогенез. Способствует формированию костного матрикса и отложению кальция.
Фоллистатин (Follistatin) — одновременно блокирует как миостатин, так и его рецептор (активин II б); анаболический регулятор роста скелетных мышц. Вместе с креатинином — любимая анаболическая добавка бодибилдеров (к слову: мышцы то растут, но сила не прибавляется).
Играет важную роль в подавлении воспаления в легких и уменьшении их фибротизации через блокирование рецептора активина–A, который индуцирует синтез провоспалительных цитокинов интерлейнина-1бета (IL-1β), интерлейкина-6 (IL-6) и фактора некроза опухолей (TNF-α).
Сукцинат (Succinate) — увеличивает синтез белков и стимулирует мышечную гипертрофию.
Ангиопоэтин 1 (Angiopoietin- 1; ANGPT-1) — сосудистый протектор.
Фактор роста фибробластов — 21 (FGF-21) — секретируется печенью, мышечной тканью, жировой тканью, поджелудочной железой. Участвует в регуляции углеводного и липидного обмена. Снижает уровень глюкозы и триглицеридов, повышает чувствительность к инсулину и усиливает липолитический ответ. FGF-21 участвует в «побурении» «белого» жира, окислении липидов и термогенезе, а также стимулирует экспрессию адипонектина в кровоток. Вырабатывается под воздействием холода и физических нагрузок. Усиливает экспрессию PGC- 1α.
Адипонектин (Adiponectin) — оказывает противовоспалительное действие на иммунную систему. В ЦНС способствует увеличению потребления пищи и уменьшению воспаления в гипоталамусе. В печени и скелетных мышцах увеличивает окисление жирных кислот и чувствительность к инсулину, улучшает функцию бета–клеток. Адренергическая бета-сигнализация; синтез индуцирован физическими упражнениями, взаимно способствует увеличению синтеза фактора роста фибробластов-21 (FGF-21), интерлейкина-15 (IL-15) и ирисина. Хондропротективный; стимулирует пролиферацию хондроцитов, повышает синтез коллагена II типа и аггрекана.
Интерлейкин-15 (IL-15) провоспалительный цитокин, который регулирует активность Т- лимфоцитов и клеток натуральных киллеров (NK). Как миокин обладает анаболической активностью и вызывает гипертрофию мышц. Стимулирует выработку сократительных белков и препятствует апоптозу миоцитов за счет предотвращения оксидативного стресса; способствует поглощению глюкозы скелетными мышцами и окислению жирных кислот. Снижает количество циркулирующих липопротеинов низкой плотности — основного переносчика холестерина в крови. Усиливает митохондриальную активность миоцитов. Отрицательно связан с ожирением: синтез интерлейкина-15 приводит к значительному уменьшению жировой массы тела за счет подавления дифференцировки предшественников адипоцитов. Повышает способность остеобластов накапливать минералы в костном матриксе; увеличивает минеральную плотность кости за счет уменьшения ее резорбции. Хондронегативный в больших количествах — повышает синтез матриксных металлопротеиназ (ММР). Отодвигает по срокам старение кожи.
Ирисин (Irisin; иногда — иризин) — PGC-1α зависимый: увеличивает объем мышц за счет активации миогенеза и способствует окислительному метаболизму в миофибриллах. Улучшает кортикальную массу костной ткани и подавляет остеокластогенез. Оказывает противовоспалительное действие в адипоцитах и макрофагах, повышает их способность к фагоцитозу, подавляет экспрессию провоспалительных цитокинов через ингибирование MAPK и NF-kB сигнальных путей. Оказывает антиоксидантный эффект на клетки. Оказывает системное влияние на различные органы. Защищает бета-клетки от апоптоза. Уменьшает пироптоз клеток (смерть «разрывом»). Стимулирует «побурение» белого жира и способствует термогенезу. Подавляет дифференцировку предшественников адипоцитов в зрелые адипоциты. Хондропозитивный; положительно влияет на дифференцировку хондроцитов.
Метеорин–подобный (Metrnl) — PGC-1α зависимый: при силовых нагрузках способствует гипертрофии мышц. Участвует в регуляции иммунного ответа. Противовоспалительный через подавление PI3K/AKT/NF-κB и антипироптозный. Кардиопротективный; усиливает ангиогенез в миокарде.
Инсулиноподобный фактор роста-1 (IGF-1). Открыт в 1957 году. Вырабатывается в печени, мышцах и костях — основной анаболический фактор в скелетно-мышечной системе. Способствует росту мышц. Стимулирует костеобразование и улучшает качество костей. Хондропротектор. Стимулятор нейротрофического фактора головного мозга (нейропротектор).
Фактор ингибирования лейкемии (LIF) принимает активное участие в регуляции развития мышц (способствует гипертрофии), регенерации и метаболизме. Регулирует работу остеокластов и остеобластов. Подавляет дифференцировку адипоцитов (жировых клеток). Защищает против кахексии.
Остеокальцин (OST; белок костного матрикса) — регулирует мышечную массу и способствует гипертрофии мышечных волокон, восстанавливает способность к физической нагрузке через перекрестную связь с интерлейкином-6 (IL-6). Регулирует метаболизм глюкозы и энергии и, косвенно, рост костей. Повышает чувствительность к инсулину.
Лиганд рецептора-активатора ядерного фактора-каппа–би (RANKL) — синтезируется костной тканью и некоторыми иммунными клетками. Регулирует накопление кальция (Ca2+) и активность фермента, отвечающего за его внутриклеточную транспортировку, влияет на функцию мышц. Активирует остеокластогенез и способствует потере костной массы.
Интерлейкин-8 (IL-8) — хемокин, который приманивает в основном нейтрофилы. Провоспалительный, но при эксцентрической нагрузке локально в мышцах увеличивает капилляризацию, что благоприятно сказывается на репарации и регенерации мышц.
Интерлейкин-10 (IL-10) — индуцирует противовоспалительные эффекты и повышает толерантность к глюкозе. Главный «переключатель» макрофагов из М1 типа (провоспалительный) в М2 тип (репаративный противовоспалительный).
Остеоглицин (Osteoglycin; OGN) — повышает захват и катаболизм глюкозы и жирных кислот, повышает циркулирующий уровень IL — 6. Повышает уровень щелочной фосфатазы, синтез коллагена I типа и остеокальцина.
Белок теплового шока-90 (HSP-90) — активирует интегрины, что позволяет клеткам связываться с ирисином.
Белок теплового шока-70 (HSP-70) — кардиопротективный.
Белок теплового шока-72 (HSP-72) — повышает чувствительность к инсулину и толерантность к глюкозе.
Белок теплового шока-27 (HSP-27) — снижает клеточный апоптоз.
Оксид азота (NO) (мышечный, нагрузочный/постнагрузочный) — вазодилататор; улучшает функцию эндотелия сосудов.
Фракталкин (CX3CL-1) — защищает бета-клетки поджелудочной железы (синтез инсулина) против фактора некроза опухоли-альфа (TNF-α). Усиливает нейрогенез в гиппокампе. Регулирует резорбцию кости, усиливает апоптоз хондроцитов.
Альфа–кетоглутаровая кислота — стимулирует мышечную гипертрофию и снижение массы жировой ткани.
Интерлейкин-7 (IL-7) — иммуномодулятор. Играет роль в развитии мышечных клеток. Регулирует резорбцию кости (подавляет остеокластогенез); хондронегативный (в больших количествах разрушает хрящевую ткань).
(Мышечный) Нейротрофический фактор головного мозга (BDNF) способствует росту мышц за счет участия в окислении жиров. Связывается с остеобластами и хондроцитами и улучшает костеобразование. Регулирует выживаемость, рост и «сервисное обслуживание» нейронов. После травм отвечает за репарацию и регенерацию нервных волокон. Модулирует синаптическую пластичность нейронов. Снижает количество фибриновых тромбов.
S 100 (кальпротектин) — принимает участие в воспалительных и регенеративных процессах за счет регуляции транспорта кальция.
Мусклин (Musclin, остеокрин) — повышает физическую выносливость и способствует биогенезу митохондрий. Регулирует рост костей (подавляет остеокластогенез и регулирует ремоделирование). Повышает захват глюкозы и синтез гликогена, защищает против потери мышечной ткани при раковых заболеваниях, контролирует кровяное давление и сократительную способность сосудов.
Остеонектин (SPARC) — регулирует ремоделирование скелетных мышц, подавляет адипогенез, влияет на системную толерантность к глюкозе. Регулирует костеобразование, подавляет рост опухолей. Участвует в накоплении коллагена и ремоделировании экстраклеточного матрикса. Отвечает за модуляцию экспрессии провоспалительных цитокинов, которые влияют на резистентность к инсулину.
Онкостатин-М — подавляет пролиферацию и индуцирует апоптоз раковых клеток (толстая кишка, грудь).
Металлопротеиназа–2 (ММР — 2) — повышает клеточную пролиферацию и дифференцировку, поддерживает гомеостаз экстраклеточного матрикса. Обладает провоспалительными и противовоспалительными свойствами (зависит от цитокинового «фона»).
Фоллистатин подобный протеин 1 (FSTL — 1) (мышечный) — стимулирует захват глюкозы, влияет на функцию эндотелиальных клеток, повышает функционал бета–клеток, смягчает фиброз печени при функциональных повреждениях, поддерживает рост и развитие кардиомиоцитов. FSTL-1 отвечает за регенерацию сердечной мышцы за счет активации ангиогенных факторов.
Бета-аминоизомасляная кислота (BAIBA) — повышает митохондриальную функцию, усиливает противовоспалительные эффекты, снижает накопление жира, снижает фиброз почек, улучшает резистентность к инсулину и снижает воспаление в скелетных мышцах. Защищает остеоциты от воздействия активных форм кислорода (АФК) и предотвращает потерю костной массы при разгрузке нижних конечностей, уменьшает последствия глюкозно/липидных метаболических нарушений, вызывает «побурение» белого жира.
Катепсин В (CTSB) — усиливает выработку нейротрофического фактора головного мозга (BDNF) в гиппокампе и стимулирует нейрогенез, что благоприятно сказывается на когнитивных способностях; улучшает память, увеличивает нейрогенез в гиппокампе.
Wnt-3а (белок) (источник — костная ткань) — активирует миогенез и усиливает способность мышц к сокращению. Положительно регулирует костеобразование.
Склеростин (SOST) — отрицательно регулирует костеобразование через блокирование Wnts.
Белок 1, родственный Диккопфу (Dkk1) — отрицательно регулирует костеобразование через блокирование Wnts.
Фактор роста фибробластов-23 (FGF-23) (костный) отрицательно влияет на кардиомиоциты (мышцы сердца). Регулирует реабсорбцию фосфатов, поддерживая нормальное содержание минералов в костной ткани.
Фактор роста фибробластов-2 (FGF-2) — усиливает формирование кости и участвует в репарации костей.
Простагландин Е2 (PGE-2) (костный) — усиливает миогенез за счет стимулирования пролиферации миобластов и улучшает сократительную функцию мышц; регулирует рост костей.
Остеопрогерин (OPG) — подавляет активность остеокластов; продуцируется остеобластами под действием кальцитонина или эстрогенов.
Мионектин (CTRP 15) — повышает утилизацию глюкозы и стимулирует окисление жирных кислот.
Апелин (Apelin) — контролирует кровяное давление и сократимость миокарда, снижает риск гипертрофии сердца, повышает усвоение глюкозы, улучшает когнитивные способности. Усиливает синтез ММР-1,3 и 9 и IL-1β. Снижает синтез коллагена II типа. Мышечный апелин улучшает митохондриальный биогенез, повышает синтез сократительных белков, стимулирует дифференцировку стволовых клеток по мышечному типу, препятствуя старческой саркопении.
Цилиарный нейротрофический фактор (CNTF) — нейротрофин (нейтрофин), обеспечивающий выживаемость нейронов, их развитие, пластичность синапсов и в качестве миокина (!) предотвращает оссификацию мышц; регулирует развитие периоста, при этом подавляет дифференцировку остеобластов и формирование кости, вызывая остеопороз.
Костный морфогенный протеин (BRINP3; FAMSC) — усиливает дифференцировку остеобластов (формирование кости).
Хемокин CXCL 10 — критический фактор ангиогенеза, связанного с физическими упражнениями.
Фактор роста эндотелия сосудов (VEGF) — PGC-1α зависимый — стимулирует рост новых капилляров и сосудов как реакция на рабочую гипоксию мышц.
L-Лактат — усиливает ангиогенез в головном мозге и улучшает мозговую функцию. Является посредником между метаболизмом жировой ткани и физической нагрузкой через стимуляцию синтеза трансформирующего фактора роста — бета 2. Регулирует иммунный ответ, принимает участие в репарации тканей и поддержании гомеостаза. Пиковый «постнагрузочный» лактат усиливает синтез коллагена II типа; при «перегрузке» системы лактатом при длительной интенсивной работе повышает синтез аггреканаз и металлопротеиназ, снижает синтез коллагена II типа (функция «контроль/ремоделирование»).
Хемокин CXCL12 — защищает от потери мышечной массы при кахексии, поддерживает рост мышц.
Дифференциальный фактор роста 15; макрофаг-подавляющий цитокин 1 (GDF -15) — противовоспалительный, снижает оксидативный стресс.
Активин А — принимает участие в регуляции «созревания» кости и хондрогенезе.
Итак. Физическая активность (упражнения) стимулирует высвобождение экзеркинов — цитокинов физической нагрузки. Сюда входят миокины, остеокины, кардиокины (здесь не упоминаются), гепатокины (не упоминаются), адипокины, цитокины и прочие «-кины».
Приведу примеры костно-мышечного перекрестного взаимодействия:
Нагрузка на кости скелета приводит к выбросу в кровь остеокальцина (OCN) и [костного] инсулиноподобного фактора роста-1 (IGF-1), которые стимулируют метаболизм мышц и вызывают их гипертрофию через усиление синтеза коактиватора-1α (PGC-1α). Связывание остеокальцина с андрогенным рецептором (GPCR6A) в мышцах усиливает адаптацию к физическим упражнениям и улучшает общую физическую форму. Остеокальцин усиливает синтез адипонектина [противовоспалительного] и витамина D. Остеокальцин способствует транслокации [перемещению] в ядро клетки активированного эритроидного фактора Nrf2 (антиоксидантная функция), что влияет на митохондриальный биогенез мышц. Остеокальцин стимулирует увеличение количества глюкозного транспортера 4 типа (GLUT4) на мембранах мышечных клеток, что усиливает усвоение глюкозы и гликолиз, таким образом повышая мышечную производительность.
Силовая нагрузка усиливает синтез остеокальцина, остеопрогерина и фактора роста фибробластов-23, при этом снижает синтез рецептора активатора ядерного фактора каппа би, его лиганда (RANK/RANKL) и склеростина. Остеопрогерин подавляет активацию рецептора RANK через связывание с RANKL [деактивация блокированием]. Лактат, который производится при интенсивных нагрузках, связывается со своим рецептором (Gpr81) на мембранах остеокластов и подавляет сигнальный путь ядерного фактора «каппа би» (NF-κB), предотвращая резорбцию кости. Также лактат стимулирует синтез трансформирующего фактора роста–2 бета, выступая как хондропротектор. Лактат стимулирует дифференцировку мезенхимальных стволовых клеток в остеобласты (костеобразующие). Излишек лактата после интенсивных физических нагрузок устраняется банальным растяжением мышц (самопроизвольным или принудительным) и успешно утилизируется тканями посредством кровотока.
Склеростин является ключевой молекулой костной механотрансдукции и прямым ингибитором сигнального пути Wnt/β — катенин, что негативно влияет на косте- и хондрообразование. Склеростин постоянно синтезируется остеоцитами как реакция, направленная на предотвращение избыточного костеобразования и хаотичного разрастания костей. Физическая нагрузка, приложенная к костям скелета, блокирует синтез склеростина и активирует Wnt/β — катенин сигналинг. Избыток склеростина — прямая дорога к остеопорозу. К тому же склеростин вызывает инсулинорезистентность, поддерживает воспалительные реакции организма и вносит свой вклад в метаболические расстройства. При гиподинамии костный склеростин усиливает синтез матриксного РНК (мРНК) склеростина в мышцах, что приводит к уменьшению мышечной массы.
Мышечные сокращения подавляют и снижают синтез миостатина с одновременным повышением синтеза бета-аминоизомасляной кислоты (BAIBA). BAIBA предотвращает апоптоз (смерть) остеоцитов (механочувствительных костных клеток), вызванный оксидативным стрессом через блокирование Mas-связанных G-протеин связанных рецепторов D типа. Миостатин может связываться с активиновыми рецепторами (AcvrIIB) на мембранах костных мезенхимальных стволовых клеток и препятствовать их дифференцировке в остеобласты (костеобразующие).
Интерлейкин-6, ирисин и апелин паракринно через систему кровообращения влияют на костеообразование и резорбцию костей, таким образом поддерживают гомеостатический баланс, ремодулируя костные трабекулы согласно силовым линиям. Ирисин усиливает экспрессию гена RUNX2 (ключевой фактор транскрипции генов костеобразования), стимулируя дифференцировку остеобластов и подавляет транскрипцию гена SOST (склеростина), вызванную сигналами миостатина и отсутствием механического сигнала, таким образом, способствуя костеобразованию и улучшению их плотности. Ирисин связывается с альфа V/бета 5 рецепторами остеоцитов, предотвращает их апоптоз и регулирует синтез склеростина. Ирисин связывается со своим рецептором интегрином αV в остеобластах и воздействует на белок, содержащий домен фибронектина III типа 5 (FNDC5, прекурсор ирисина), стимулируя самосинтез.
В свою очередь паратиреоидный гормон понижает уровень экспрессии ирисина мышцами, соответственно и его уровень циркуляции. Дефицит витамина D приводит к гиперпаратиреодизму и гипофасфатемии, что является причиной потери костной массы. Мышечный остеоглицин регулирует пролиферацию остеобластов через стимуляцию синтеза IL-6, влияя на возможность восполнения потери костной ткани. «Хроническая циркуляция» интелейкина-6 с прочностью костей сочетается плохо. Связывание IL-6 со своим рецептором (IL-6R) стимулирует «работоспособность» остеокластов (клеток, резорбирующих кость), ремоделируя кости под нагрузкой; так называемая регуляторная ось интерлейкина-6/остеокальцина (IL-6/OCN) между миокинами и остеокинами.
Регулярная физическая активность повышает выброс адреналина, кортизола, ростовых гормонов, пролактина и других факторов с иммуномодулирующим эффектом.
Упражнения снижают экспрессию Toll-подобных рецепторов (TLR; воспалительных) на мембранах моноцитов/макрофагов (клеток иммунной системы), что понижает риск системного воспаления.
Андрогены и эстрогены регулируют физическую активность через допаминэргические пути, поэтому проблемы с половыми гормонами сразу скажутся на костях.
Также при физической нагрузке синтезируются цитокины IL-7, IL-8, IL-10 и IL-15, улучшающие капилляризацию мышц, выполняющие противовоспалительные функции за счет поляризации макрофагов во 2 тип, анаболические функции и прочее.
К полезным бонусам мышечной работы относится повышение синтеза глютамина и кинурениновой кислоты.
Аминокислота глютамин — «топливо» для клеток иммунной системы. Вырабатывается преимущественно мышцами. У нетренированных людей глютамина хватает только на синтез тканевых белков. При заболевании расход глютамина резко повышается, что приводит к энергодефициту и сбою в работе иммунной системы.
Из глютамина синтезируется глютатион — мощный антиоксидант, ксенобиотик (функция детоксикации), участвует в пролиферации и апоптозе клеток, защищает митохондрии против АФК.
Кинурениновая кислота
Физические упражнения приводят к повышению циркулирующего фермента кинуренинаминотрансферазы, который расщепляет нейротоксичный белок кинуренин в нейропротективную кинурениновую кислоту, таким образом, подавляя симптомы депрессии и нейрогенного воспаления. Повышенный уровень плазменной кинурениновой кислоты имеет противовоспалительную функцию.
Влияние на мозг
Большинство миокинов действуют паракринно — на соседние ткани и органы, но часть из них свободно проникает через гематоэнцефалический барьер и влияет на метаболизм мозга и нервной ткани. К свободно проникающим барьер относятся «мышечный» нейротрофический фактор мозга (BDNF), инсулиноподобный фактор роста-1 (IGF-1), катепсин В (CTSB), ирисин (FNDC5/IRISIN), лактат (L — Lactat) и фактор роста эндотелия сосудов (VEGF).
Ирисин участвует в нейрогенезе, нейропротекции, регулирует синтез нейротрофических факторов, влияет на усвояемость глюкозы, защищает от оксидативного стресса.
При активации сигнального пути Коактиватор-1α (PGC-1α) — Ирисин — Нейротрофический фактор головного мозга в гиппокампе резко усиливается локальный синтез «мозгового» нейротрофического фактора (BDNF), что улучшает память, когнитивные способности, уменьшает симптомы депрессии.
L-лактат является «топливом» для митохондрий нервных клеток и также увеличивает локальный синтез нейротрофического фактора мозга (BDNF) за счет активации сигнальных путей коактиватора-1α (PGC-1α) и сиртуина-1 (SIRT-1). L-лактат усиливает действие фактора роста эндотелия сосудов (VEGF), который обеспечивает нейрогенез в гиппокампе за счет улучшения его капилляризации.
Вышеперечисленные факторы взаимоусиливают действие через общие сигнальные пути и выполняют синергетическую функцию нейропротекции, нейрогенеза, улучшают нейросигналинг, предотвращают/отодвигают по срокам развитие дегенеративных болезней мозга и снижают депрессию. В качестве бонуса — улучшение сна и настроения.
Адипокины
Действию миокинов и остеокинов противостоит действие адипокинов.
В представлениях обывателя жировая ткань является пассивной тканью. Это крайне опасное заблуждение. Жировая подкожная прослойка нам дана вместо шерстяного покрова и служит для термогенеза и защиты от холода. Внутренние жировые отложения — это большой эндокринный орган, который, в основном, работает против своего хозяина. Причем делает он это исподтишка.
Провоспалительные адипокины, синтезируемые жировыми клетками — адипоцитами, — вообще страшная вещь. Висцеральный и подкожный жир являются прекрасным депо для клеток иммунной системы — моноцитов/макрофагов, которые при активации адипокинами поляризуются в 1 тип — провоспалительный. С повышением процента жировой массы при гиподинамии возрастает и концентрация провоспалительных цитокинов, синтезируемых макрофагами 1 типа, в то время как доля противовоспалительных миокинов снижается, что ведет к различным метаболическим нарушениям. По сути, избыточная жировая масса — это «химическая» бомба с замедленным действием.
Адипоциты синтезируют огромное количество RANKL, который имеет липотоксический эффект на остеобласты и стимулирует пролиферацию остеокластов — разрушителей костей [остеоартриты у людей с избыточным весом].
Избыток циркулирующих адипокинов — основная причина низкогредиентного хронического воспаления в организме.
Адипокины [указана часть функций]
Лептин (Leptin) — в иммунной системе увеличивает количество провоспалительных цитокинов. В ЦНС способствует уменьшению потребления пищи и увеличению глобальных затрат энергии. В скелетных мышцах участвует в абсорбции и окислении глюкозы и свободных жирных кислот через индукцию синтеза мышечного IL-6. В печени усиливает окисление жирных кислот и уменьшает накопление липидов.
Резистин (Resistin) — провоспалительное действие на иммунную систему. «Замешан» при эндотелиальной дисфункции, сердечно-сосудистых заболеваниях; ингибирует инсулин-сигналинг через супрессор передачи сигналов цитокина 3 (SOCS3).
Аспросин (Asprosin) — увеличивает потребление пищи и массу тела, ускоряет выработку глюкозы в печени.
Хемерин (Chemerin) — усиливает нетолерантность к глюкозе и затрудняет инсулин-сигналинг. Активатор Toll-подобных рецепторов.
Оментин (Omentin) — оптимизирует действие инсулина и, следовательно, всасывание глюкозы. Он также действует как антиатеросклеротический фактор.
Секретируемый фризлд-связанный протеин 5 (Secreted frizzled-related protein 5; SFRP5) — регулирует экспрессию провоспалительных цитокинов путем ингибирования передачи сигналов Wnt5a.
Липокалин 2 (Lipocalin 2) — участвует в регуляции воспаления, транспорте жирных кислот и железа. Связан с сердечно-сосудистыми заболеваниями, ремоделированием сосудов и нестабильностью атеросклеротических бляшек.
Васпин (Vaspin) — снижает синтез провоспалительных цитокинов; снижает нетолерантность к глюкозе и улучшает чувствительность к инсулину; защищает клетки эндотелия от апоптоза, вызванного жирными кислотами (защита сосудов); защищает бета-клетки от воспалительного повреждения, опосредованного ядерным фактором κB (NF-κB). Выступает как иммуномодулятор (поляризует макрофаги во 2 тип — противовоспалительный).
Фоллистатин подобный протеин 1 (FSTL1) (жировой). Связан с избыточным весом и ожирением. Низкие уровни FSTL1 связаны с суперожирением из-за нарушения адипогенеза, увеличением размера созревших адипоцитов и клеточным старением. Он оказывает провоспалительное действие за счет повышения уровня провоспалительных цитокинов (усугубляет течение артрита). Экспрессируется в больших количествах жировой тканью в состоянии низкогредиентного хронического воспаления.
CTRPs (C1Q Tumor necrosis factor-related proteins) — аналог адипонектина — принимает участие в регуляции воспалительных процессов в жировой ткани. Регулирует обмен глюкозы и жиров в периферических тканях при приеме пищи.
FAM19A5 (Family With Sequence Similarity 19, Member A5) — подавляет пролиферацию и вызывает воспаление гладкомышечных клеток сосудов, связан с сердечно-сосудистыми заболеваниями, вызванными ожирением.
WISP1 (WNT1 inducible signaling pathway protein 1) — стимулирует цитокиновый ответ в макрофагах, связанных с жировой тканью; индуцирует пролиферацию мезенхимальных стволовых клеток по жировому типу, что увеличивает объем жировой ткани.
Програнулин (Progranulin) — обладает противовоспалительными свойствами. Гиперпрогранулинемия связана с резистентностью к инсулину и недостаточностью передачи сигналов инсулина.
Несфатин-1 (Nesfatin-1) — вызывает чувство насыщения, что способствует снижению массы тела. Также может регулировать растяжение и перистальтику желудка через меланокортиновый путь в центральном ядре миндалины.
Висфатин (Visfatin) — вызывает воспаление адипоцитов, резистентность к инсулину и дисфункцию бета-клеток поджелудочной железы. Хондронегативный и катаболический для хрящевой ткани: вызывает оксидативный стресс хондроцитов и их апоптоз.
Фетуин-А (Fetuin-A) — связан с резистентностью к инсулину и системным воспалением.
ЗАГ (ZAG zinc- 2-glycoprotein) — Действует на ускорение липидного обмена, регулируя ферменты липогенеза и липолиза; стимулирует выработку адипонектина в бурой жировой ткани. «Замешан» в иммунных ответах при канцерогенезе.
Многие люди рассматривают «здоровье» как «не болезнь». Соответственно, если не болит — значит, проблем нет. Поэтому залечивание и банальное обезболивание принимают за выздоровление. Большой процент реконвалесцентов («выздоравливающих») по факту просто балансируют на грани предболезни и при неудачном стечении обстоятельств легко повторно заболевают и хронизируются.
Для каждой болезни существуют свои главные «игроки» и для противодействия или нейтрализации конкретных миокинов, остеокинов, адипокинов и прочих цитокинов нужно обращаться к профильным специалистам. Там у каждого «своя кухня» и свои «злостные хулиганы» и зачинщики заболеваний…
Прямого отношения к здоровью врачи не имеют — они изучают болезни и занимаются их лечением. Врач может поставить точный диагноз, назначить симптоматическое (или другое) лечение и порекомендовать двигательный режим, который будет препятствовать обострениям и хронизации заболевания. Также врач перенаправляет больного к узким специалистам, если требуется более серьезное (или прицельное) вмешательство. Специалисты по физической реабилитации занимаются восстановлением утраченных функций и к здоровью пациентов имеют лишь косвенное отношение: они могут провести необходимые нейро-ортопедические тесты и манипуляции, подобрать подходящий двигательный режим и упражнения, целью которых будет максимальная адаптация к заболеванию или его компенсация.
Для полноценного восстановления поврежденной мышцы требуется минимум 3 месяца; для связок — минимум полгода; при повреждении межпозвонкового диска — 1 год минимум без лишних разговоров и пререканий.
Спорадическое лечение и реабилитация на фоне завышенных ожиданий и неистребимой веры в чудо представляют собой реальную проблему для работников медицинской сферы.
По факту между врачами и пациентами существует конфликт целей. Цель пациента — получить быстрое и качественное лечение, причем мгновенно и желательно на халяву [а за что платить? Как лечить можно почитать в интернете. Ладно, раз уж я к тебе пришел — давай лечи!]. Профессиональной целью врача является оказание медицинской помощи в рамках реального, а не вымышленного патогенеза заболеваний. Причем очень часто врач работает под бюрократическим прессом и на основе клинических рекомендаций, которые могут быть с фармакологическим «душком» [большинство «рекомендаций» пишутся под диктовку менеджеров из фарм корпораций]. Чаще всего, пошаговый алгоритм лечения на основе таких рекомендаций не устраивает и самих пациентов. Первое «фи» — дорого; второе — активное долечивание — лень, пассивное — «так уж и быть, на массаж похожу… Все остальное — на мое усмотрение» (режим сна, отказ от вредных привычек и пр.).
Проблемы со спиной можно решить только в том случае, если больной осознает и примет тот факт, что его здоровье [вообще никому не нужно, скорей-наоборот] не зависит от внешнего разового постороннего вмешательства. Если «чудо» и произошло, то это говорит только об одном — проблема была крайне незначительной и спонтанно саморазрешимой.
Реабилитация — это не событие, не череда мероприятий, это — длительный процесс, в котором время от времени может требоваться участие профильных специалистов. Кратковременные часовые сессии, по сути, не являются реабилитацией как таковой. Это всего лишь разучивание некоторых физических действий (упражнений), которое направлено на обучение пациента десенсибилизирующей двигательной активности. Под десенсибилизацией понимают ряд мероприятий, направленных на повышение болевой толерантности и возврат к привычной деятельности. [Массаж или применение обезболивающих средств — это тоже десенсибилизация, только пассивная].
Понятно, что ни врач, ни реабилитолог не будут каждому своему пациенту рассказывать, как функционирует организм и как взаимодействуют иммунная, нервная, сердечно-сосудистая и скелетно-мышечная система. Врач ограничится рекомендациями побольше времени проводить на свежем воздухе и заниматься посильной физической активностью. Никто никого уговаривать не будет. Здоровье ваше — делайте с ним что хотите. Специалисты по реабилитации заставляют своих пациентов мышечно «напрягаться» (часто на пределе возможностей), но это такая работа — восстанавливать двигательные функции пациента через активацию миокино-остеокиновых и других «осей». В теле человека насчитывается порядка 200 типов клеток и большинство из них — механочувствительные. Клетки иммунной системы так вообще засекают любой «движ» и изменение тканевого гомеостаза (плотность ткани, напряжение, изменение химического состава и пр.). Или не засекают, если хроническая гиподинамия вызвала преждевременное «старение» или дисбаланс реактивности иммунной системы. А вместе с такими изменениями — нарушение гомеостаза и кучу болячек.
К чему я веду. Ни врач, ни реабилитолог, физически не в состоянии постоянно следить за «накачкой в систему» пациента нужного объема анаболических миокинов, противовоспалительных цитокинов и ростовых факторов, которые принимают участие в репарации/регенерации поврежденной ткани. Чисто гипотетически над пациентом можно поставить реабилитолога с дрыном или нагайкой и, таким образом, «контролировать» и «стимулировать» процесс на протяжении полугода — года. Но это уже будет из разряда «БДСМ — реабилитации», которую потянуть финансово смогут не все пациенты. Так что в большинстве случаев пациент предоставлен сам себе и лично отвечает за выполнение рекомендаций по лечению и реабилитации. Перекладывание ответственности с «больной головы на здоровую» — практика широко распространенная. С точки зрения пациента в неудаче лечения всегда виноват или врач, или реабилитолог. Пациент поначалу что-то делал, у него где-то заболело, он расстроился и бросил это «гиблое дело». Купил в аптеке нестероидные и вроде немного стало легче…
Поскольку действие многих миокинов хорошо изучено и описано, фармакологическая промышленность быстро подсуетилась и наладила выпуск и продажу многих миокинов прямо баночной расфасовкой. Они это называют «Exercise Mimicking Drugs», то есть препараты, которые имитируют действие физических упражнений. В легенде это звучит красиво: для лечения возрастной саркопении, кахексии и прочее. По факту, большинство «продукции» поедается бодибилдерами и озабоченными собственным внешним видом и здоровьем.
Дегенеративная болезнь диска
Переходим к рассмотрению механизмов самой распространенной причины хронических болей в пояснице — дегенеративной болезни диска. Данное поражение позвоночника также известно как «межпозвонковый остеохондроз», «остеохондроз», «остеохондроз позвоночника», «дискоз», «активная дископатия», «остеоартрит позвоночника», «дискогенная боль».
Немного анатомии. Диск представляет собой диартроз (полусустав) — сочленение между двумя костями — позвонками. Комплект из двух позвонков и соединяющий их диск называется позвоночно-двигательный сегмент (ПДС).
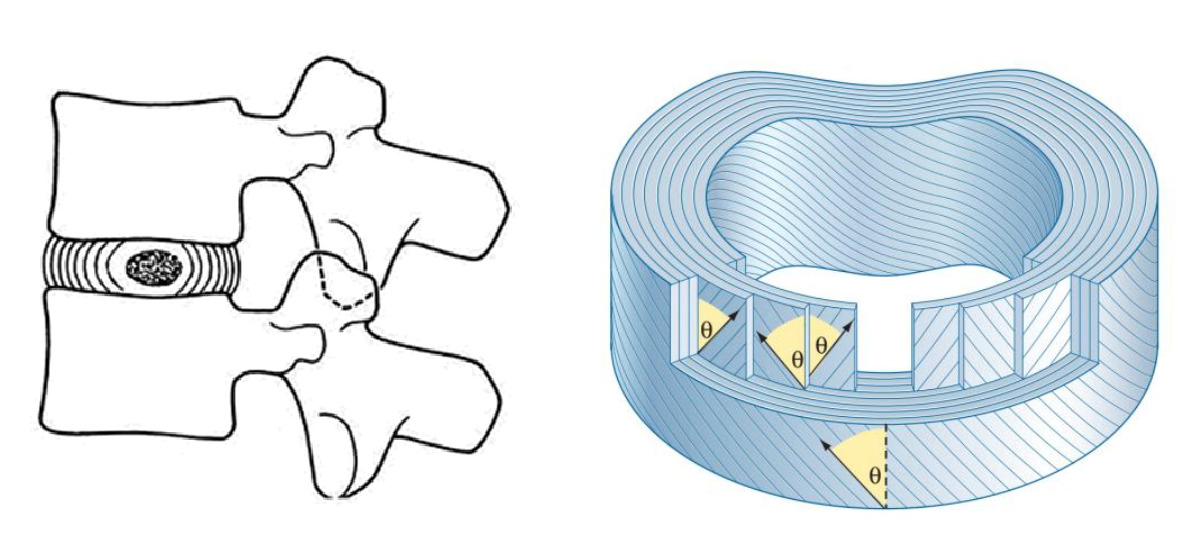
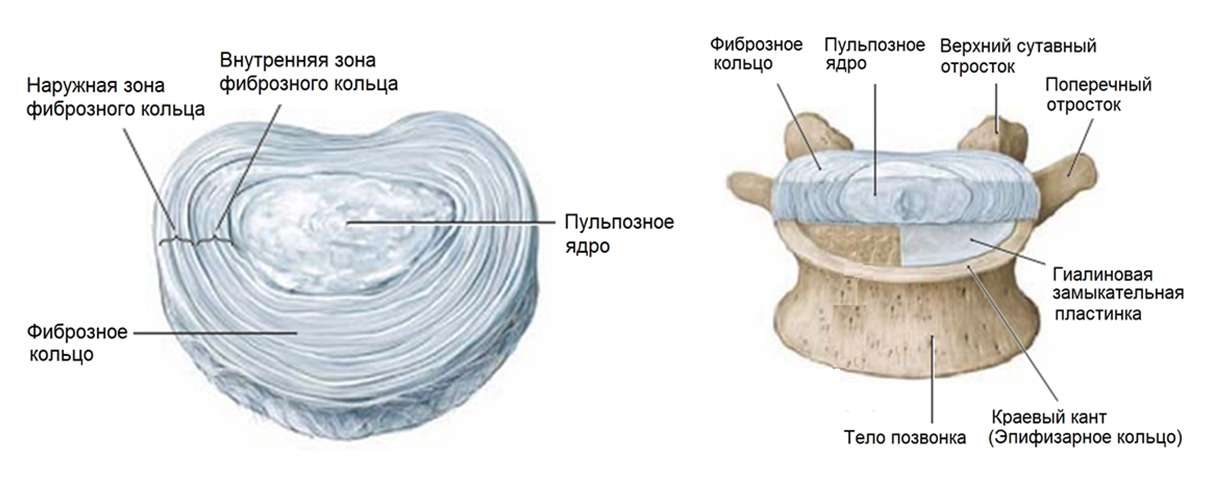
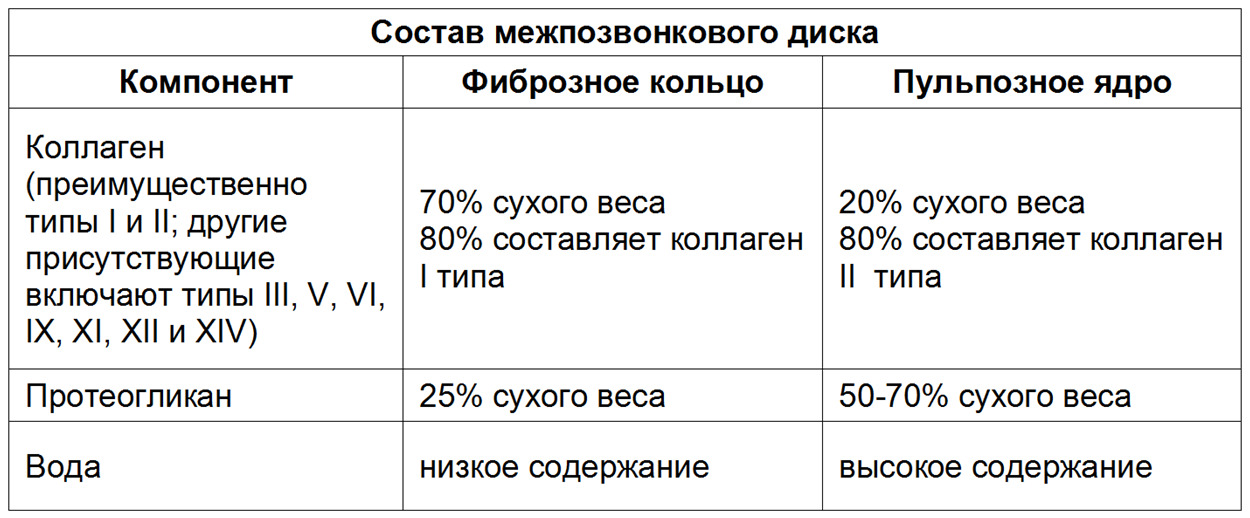
Строение и метаболизм диска современного человека имеет особенность, отличающую его от дисков млекопитающих, передвигающихся на четвереньках. В пульпозном комплексе у взрослого человека отсутствуют клетки нотохорды, синтезирующие значительное количество протеогликанов, структурных белков, поддерживающих высокое осмотическое давление в диске. К 4 — 10 годам у человека они замещаются хондроцитоподобными клетками, что значительно изменяет метаболизм и физические свойства диска. Часть хондроцитоподобных клеток фенотипически сходны с клетками нотохорды (вероятно, являются их производными) и способны синтезировать больше структурных белков, чем обычная зрелая клетка пульпозного комплекса диска. Чем выше соотношение нотохордоподобных клеток по отношению к хондроцитоподобным, тем выше способность синтеза структурных белков и тем «живуч» межпозвонковый диск. Переход к прямохождению привел к необходимости смещения амортизирующей части диска ближе к оси вектора гравитации с целью более равномерного распределения компрессионной нагрузки и повышения демпфирующих свойств. Если у передвигающихся на 4 конечностях млекопитающих буферный пульпозный комплекс располагается по центру диска, то у человека он смещен назад в поясничной и шейной области и вперед в грудной.
Таким образом, соотношение фиброзного кольца спереди и сзади 2/1. Бывает даже 3/1. Слабость задней стенки можно рассматривать как предрасполагающий фактор к раннему развитию дистрофии задней части диска и грыжеобразованию.
Анатомически диск состоит из трех основных составляющих: фиброзного кольца, пульпозного комплекса и верхней и нижней замыкательных пластинок.
Функционально фиброзное кольцо состоит из двух частей: собственно внутреннее кольцо, являющееся стенкой амортизирующей капсулы (с гелеподобным содержимым) и наружный футляр — плотная оболочка, удерживающая амортизирующую капсулу на месте (Анатомия по Неттеру).
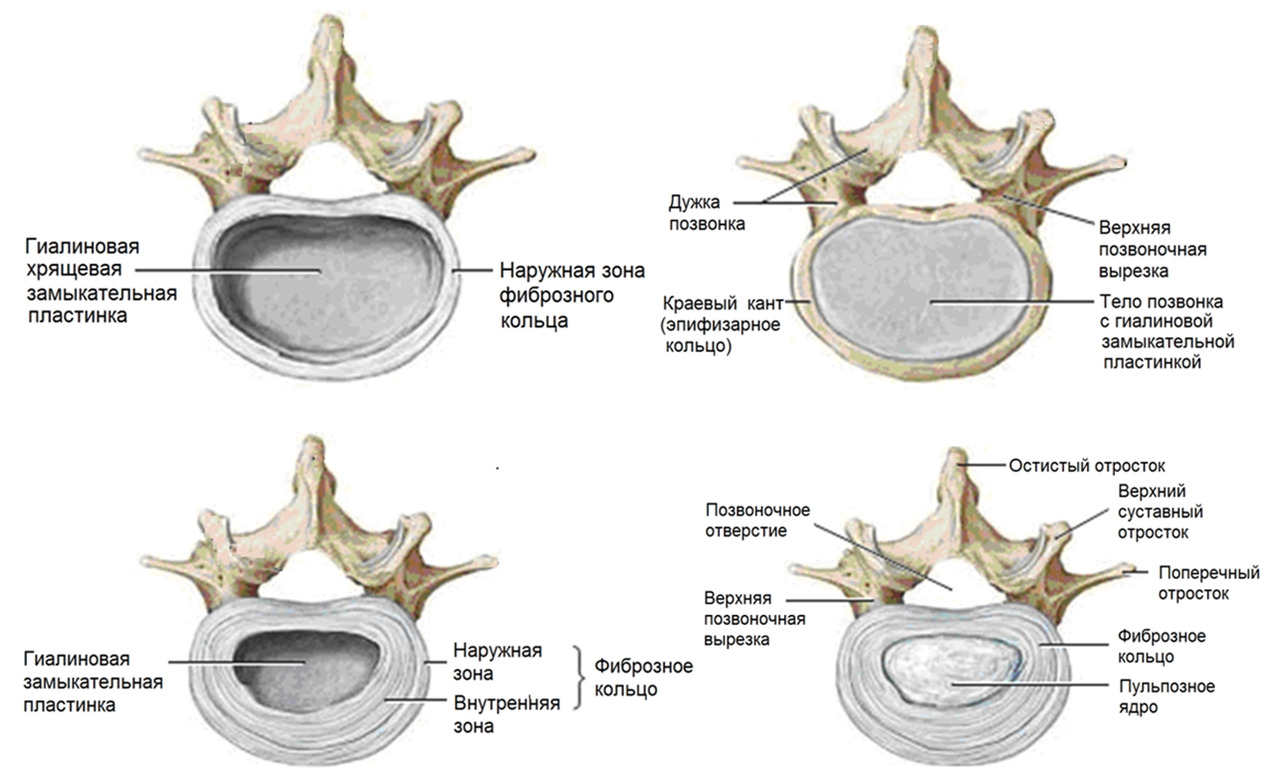
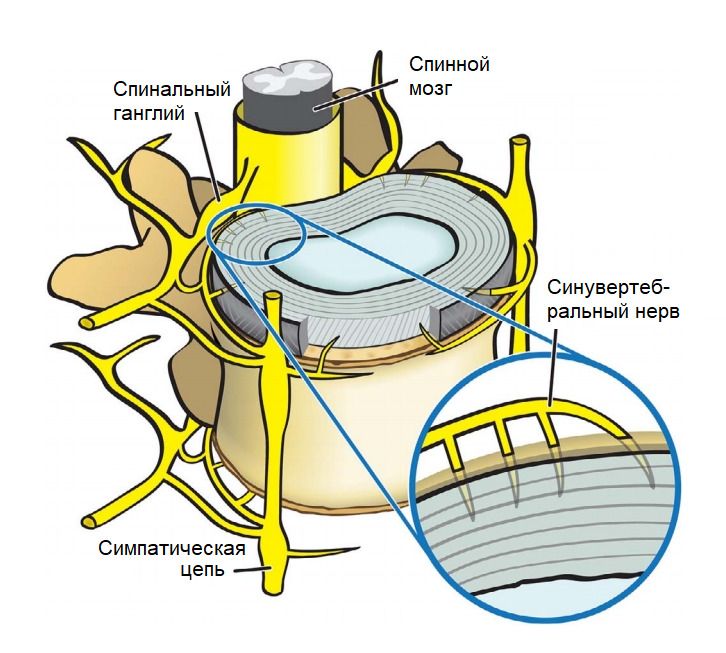
Наружное кольцо (аналог капсулы сустава), жестко сращено шарпеевыми волокнами с костным краевым кантом позвонков — лимбусом. Основная функция — удержание амортизирующего дика (капсулы с гелем) на месте и противодействие тангенциальным, тракционным, сгибающим/разгибающим и ротационным нагрузкам.
Наружные слои (ламели) состоят из строго упорядоченных волокон плотного коллагена I типа, которые вырабатываются клетками фибробластами. Каждый слой имеет свое отличное от соседних направление волокон. Питание наружных слоев фиброзного кольца осуществляется через капилляры близлежащих сосудов. Задняя и боковые части наружной части кольца хорошо иннервированы чувствительными веточками синувертебрального нерва. Передняя часть — симпатическими волокнами. Глубина иннервации может достигать 3,5 мм. Боковые части диска содержат группу различных механорецепторов, участвующих в моторном контроле через реализацию миотонических рефлексов на свою сегментарную группу мышц и паравертебральные мышцы региона.
В здоровом диске между ламелями (слоями кольца) присутствует сеть волокон коллагена II типа с включением версикана и аггрекана, белков, удерживающих воду. Данная «прослойка» выполняет функцию смазки и позволяет ламелям скользить относительно друг друга при движениях. Такое независимое «скольжение» ламелей позволяет диску «мягкую» деформацию и предотвращает появление зон износа в волокнах наружных слоев. Для возврата ламелей в исходное положение предусмотрен механизм возврата к первоначальной форме. Диск прошит насквозь нитями эластина и коллагена II типа, соединяющие ламели вместе своеобразными «мостиками».
Внутреннее фиброзное кольцо представляет собой стенку амортизирующей капсулы, которая сращена с хрящевыми замыкательными пластинками, прилегающими к позвонкам.
Амортизирующая капсула — главная функциональная часть диска, которая выполняет основную задачу по распределению компрессионных и гашению ударных (при беге, прыжках) нагрузок на тела позвонков.
Капсула состоит из трех элементов:
Снизу и сверху — крыша и дно состоят из мембран — замыкательных пластин.
Замыкательные пластины представляют собой тонкие пластины из гиалинового хряща с системой трубочек и каналов, по которым питательные вещества поступают внутрь капсулы и через которые выводятся клеточные продукты жизнедеятельности и обмена. Пластины выполняют функцию мембраны-фильтра, которая позволяет проникать в полость капсулы только питательным веществам с низкой молекулярной массой.
Внешний слой замыкательной пластины, соприкасающийся непосредственно с костью, более плотный, с сетью запустевших каналов от капилляров, когда-то запитывавших диск в раннем возрасте. Во взрослом возрасте в замыкательной пластине могут находиться единичные капилляры, проникающие в пластину из костного мозга тела позвонка. Волокна замыкательных пластин строго упорядочены по направлению, плотно переплетаются с волокнами внутренних ламелей фиброзного кольца и способствуют их удержанию на своем месте при растяжении диска или при скручиваниях. Соотношение протеогликанов к коллагену 2 к 1, тогда как в пульпозном ядре — 27 к 1.
Основная клетка замыкательных пластин — хондроциты, которые вырабатывают коллаген II типа и аггрекан. Во взрослом возрасте замыкательная пластинка является «донором» хондроцитоподобных клеток для пульпозного комплекса. После смерти (апоптоза) клеток нотохорды в юношеском возрасте хондроциты мигрируют в пульпозный комплекс и сами начинают вырабатывать структурные белки протеогликаны, поддерживающие гомеостаз диска.
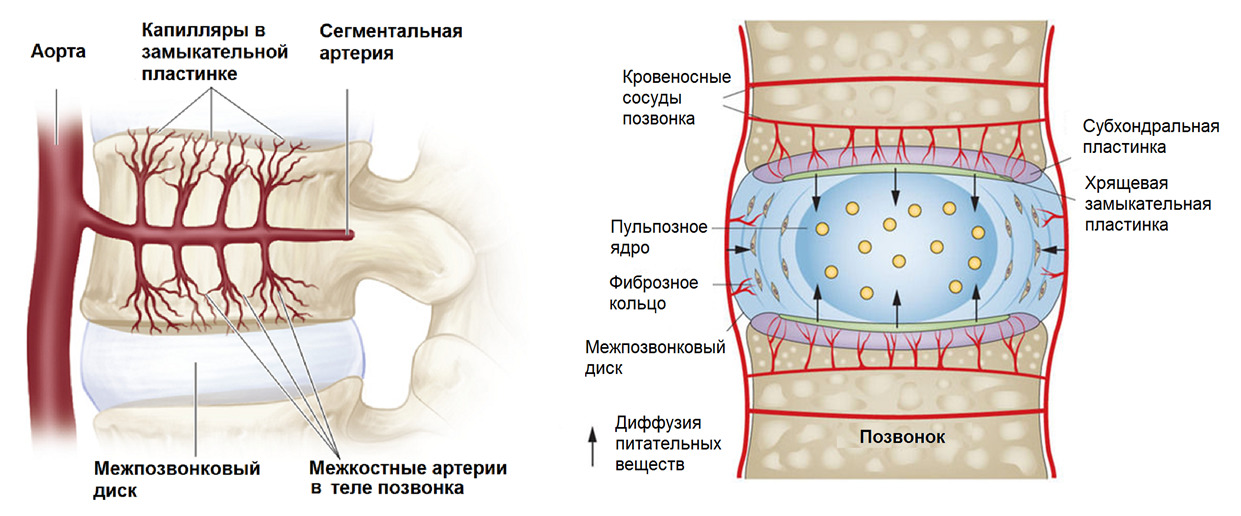
Стенки капсулы пульпозного комплекса также выполнены из листов-ламелей, но здесь прослеживается градиент коллагенового состава ламелей. Чем ближе к периферии кольца, тем больше коллагена I типа, чем ближе к пульпозному комплексу — больше коллагена II типа. Строение внутренних ламелей от более наружных отличается хаотичным расположением волокон, рыхлостью и беспорядочностью. В задней части внутреннего кольца до 40% ламелей могут быть не замкнуты и анатомически представлять собой «полукольца» или по форме напоминать «полумесяц». Подобная «рыхлость» задней части кольца также является предрасполагающим фактором к грыжеобразованию.
В молодом возрасте (до 10 лет в среднем) пульпозный комплекс представляет собой желеобразный студень, почти жидкий «холодец». Но по мере замещения клеток нотохорды хондроцитоподобными клетками, мигрирующими из хрящевого слоя замыкательных пластин и внутреннего фиброзного кольца, «холодец» начинает «застывать». Это связано с естественной запрограммированной смертью (апоптозом) клеток нотохорды. В отличие от клеток нотохорды, которые, в основном, вырабатывают протеогликаны (аггрекан и др. белки, удерживающие воду), хондроцитоподобные клетки вырабатывают большое количество коллагена II типа и немного I типа. Это ответная компенсаторная реакция на увеличение веса человека и все возрастающие компрессионные и ударные нагрузки. Другими словами, диск начинает «взрослеть» и приобретать полноценные амортизирующие свойства. Вместе с тем, также начинают появляться первые признаки дистрофии и дегенерации, которые уже могут быть хорошо заметны с 12-летнего возраста.
Хондроцитоподобные и нотохордоподобные клетки в отличие от истинных клеток нотохорды вырабатывают большое количество коллагена II типа, из которого выстраивается матрикс (матрица) пульпозного комплекса. Это своеобразный «каркас» из хаотично переплетенных коллагеновых волокон II типа. Внешне он напоминает металлическую губку для мытья посуды. Такая структура очень упруга и легко восстанавливает форму после деформации. Таким образом, одним из основных отличий «взрослого» диска от молодого является наличие хорошо развитой опорной структуры для специализированных белков, обеспечивающих амортизационные свойства диска. Весь матрикс погружен в гель, образованный многокомпонентным белком аггреканом, который обладает высокой способностью связывать и удерживать воду, тем самым обеспечивая амортизирующую функцию диска за счет поддержания высокого осмотического (гидростатического) давления (420—450 mOsm). Аггрекан прикрепляется к нитям гиалуроновой кислоты, которые переплетаясь с волокнами коллагена II типа, создают устойчивые молекулярные формы. Вырабатывается хондроцитоподобными клетками, равномерно распределенными по матриксу диска. Именно благодаря аггрекану диск связывает воду и «набухает». В его составе присутствует отрицательно заряженные белки кератан сульфат и хондроитин сульфат, которые «поглощают» воду, удерживая ее в экстраклеточном матриксе. Например, при разрыве кольца (грыжа) и выходе геля наружу, он механически не ограничен, поэтому «набирая» воду фрагмент «разбухает» и может формировать большие грыжевые выпячивания. При этом грыжа может отторгать корешковую манжету с корешками и сопутствующими сосудами и прижимать их к суставу ПДС или ножке дуги (вышележащего) позвонка.
Второй тип клеток, населяющих пульпозный комплекс — фибробласты (как в фиброзном кольце). Вырабатывают коллаген I типа. Несмотря на свою незначительность, могут играть немаловажную роль в запуске необратимых дегенеративных процессов в диске.
Весь амортизационный комплекс «прошит» радиально расположенными эластическими волокнами, которые формируют упругий эластический скелет и позволяют легко восстанавливать форму диска после деформаций. Также эластических волокон много в наружных слоях диска и выполняют они ту же функцию — способствуют возврату в исходную форму.
Непосредственно клеточные популяции как нотохордоподобных, хондроцитоподобных так и фибробластов, заселяющих диск, живут в своих околоклеточных матрицах, своеобразных апартаментах.
Функция околоклеточного матрикса — структурная и защитная для клеток.
Здоровые клетки пульпозного комплекса постоянно поддерживают оптимальный уровень продукции коллагена II типа и аггрекана, тем самым обеспечивая необходимую целостность и структуру матрикса, уровень поглощения, удержания воды и набухания ткани диска — так называемый тургор диска.
Отличительной особенностью гелевой капсулы является полное отсутствие сосудистых капилляров и отсутствие иннервации. Белок аггрекан является «токсичным» для нервных окончаний. Соответственно, он препятствует прорастанию свободных нервных окончаний внутрь диска, тем самым предотвращая появление болевого импульса при сильных компрессионных нагрузках, которым подвергается диск.
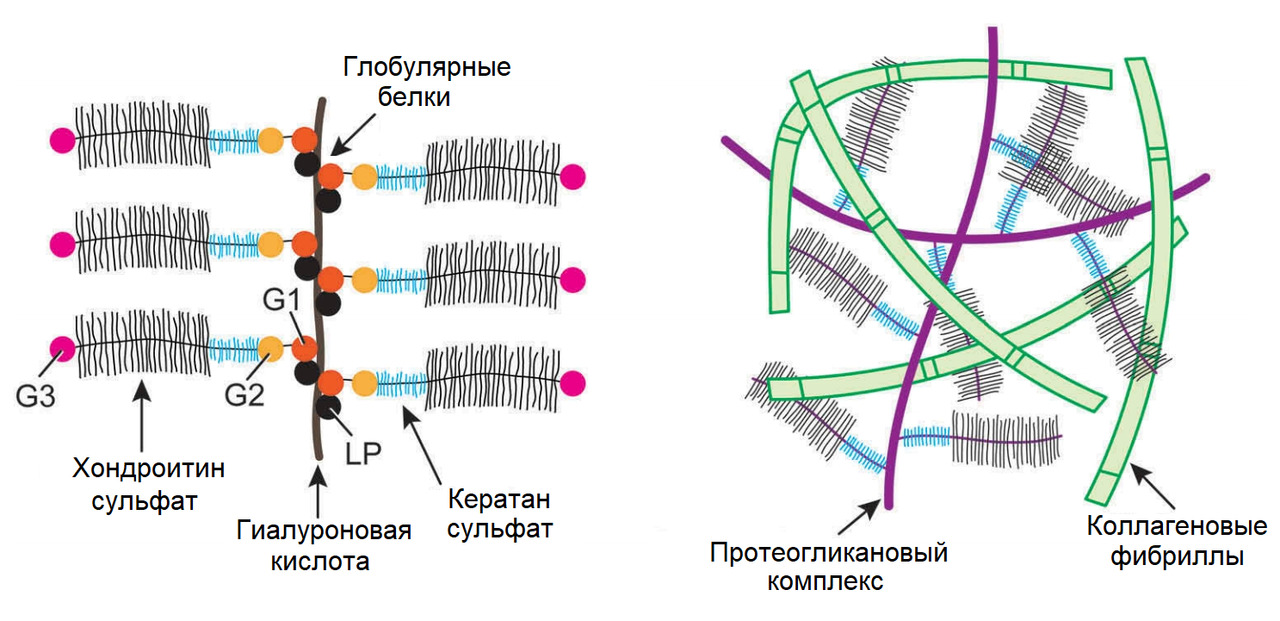
Межпозвонковый диск — самый крупный орган в теле человека, лишенный питания посредством сосудистой сети. Метаболизм и обменные процессы в диске всецело зависят от качества диффузии — механизма транспортировки питательных веществ через замыкательные пластины, непосредственного транспорта внутри матрикса и во многом от полноценной работы капиллярной сети позвонков. Диффузия питательных веществ и поддержание гомеостаза на должном уровне значительно зависят от условий, в которых работает диск. У предка человека чередование фаз сжатие-растяжение работало как насос, наполняющий капиллярную сеть внутри позвонков, что положительно сказывалось на диффузии и обменных процессах. Компрессионная нагрузка была всегда динамическая и кратковременная и значительного патологического влияния на метаболизм и обменные процессы в диске не оказывала. Скорей наоборот — стимулировала анаболизм и выведение продуктов обмена. В отличие от современного человека, у которого преобладает вертикальная статическая нагрузка в любом положении, кроме лежа. С переходом к прямохождению резко выросло требование к качеству диффузии и обеспечению обменных процессов внутри самого диска.
Если выражаться более точно, то не само прямохождение (как вид локомоции) ухудшает качество питания диска, а необходимость современного человека длительно выполнять работы в положении сидя или стоя с длительными периодами статической работы часто в комбинации с работой в эксцентрическом режиме (удержание веса перед собой плюс наклоны).
Для проведения питательных веществ через мембранный механизм замыкательной пластинки затрачивается около 2 часов (в среднем на 0,7 мм толщины пластинки) сквозь мембрану и еще около 4—5 часов транспортировки в центр диска. В среднем, в здоровом диске на доставку питательных веществ от границы капиллярного русла до центра диска затрачивается около 7—8 часов. И это при условии адекватной пропускной способности замыкательных пластин и полноценной работы капиллярной сети позвонков. Поэтому, чем выше диск (например, L4—5), тем больше времени понадобиться для прокачки питательных веществ с периферии. Выведение продуктов обмена идет по тому же пути диффузии, но только в обратном направлении. Поэтому популяция клеток центральной части диска всегда будет более уязвима в отношении питания и выведения продуктов обмена. Очень часто это физически невозможно, если нарушена диффузия через замыкательные пластины или нарушен капиллярный кровоток. Склерозирование замыкательных пластин может развиться после травмы или в результате длительного воздействия статических нагрузок. Нарушение пропускной способности капилляров, как правило, вызвано их спазмом в результате воздействия никотина (курение), вибрации (большие автомобили), снижением насосной функции мышц (длительное сидение) и сосудистыми заболеваниями (атеросклероз, диабет и др.).
В любом случае, доставка питательных веществ снижается настолько, что клетки не в состоянии поддерживать свой нормальный жизненный цикл. При этом также нарушено выведение продуктов обмена и идет процесс «самоотравления» клеток.
Поэтому естественная ходьба и кратковременные компрессионные нагрузки средней интенсивности улучшают качество диффузии и выступают анаболическим фактором, способствуя выработке клетками пульпозного комплекса структурных белков и коллагена II типа. Длительное нахождение в положении лежа, сидя или длительные компрессионные нагрузки даже низкой интенсивности выступают катаболическим фактором, приводя к ухудшению диффузии и снижению обменных процессов.
Анаболическое «окно» полноценного обмена в диске лежит в пределах 0,3—1,3 МРа (МПа; мегапаскаль). Для ориентировки: положение лежа — 0,1 МРа, компрессионная нагрузка может приводить к повышению давления до 3,0 МРа. Вся нагрузка ниже или выше значений 0,3—1,3 МРа является катаболической.
Осмотическое (гидростатическое) давление в диске лежит в диапазоне 420—450 mOsm, при этом оптимальное давление для выработки протеогликанов и экстраклеточного матрикса лежит в диапазоне 400 -500 mOsm (изоосмотическое и гиперосмотическое).
Кратковременный катаболизм тканей диска особой угрозы не представляет. Но, если речь идет о годах «катаболического стажа», тогда существует повышенный риск развития дегенеративного заболевания диска — межпозвонкового остеохондроза с последующим развитием в остеохондроз позвоночника. [Здесь нет никакой тавтологии. Это похожие по названию, но разные по клиническому проявлению «заболевания»].
При осмотическом (гидростатическом) давлении 0,3 МРа клетками синтезируется на 20% больше протеогликанов, чем при давлении 0,1 МРа (лежа). Высокая, но даже кратковременная компрессионная нагрузка выступает катаболическим фактором: замедляет, прекращает синтез структурных белков и вызывает их распад.
Весомым и, зачастую необоснованно игнорируемым фактором нарушения обменных процессов, является длительное сидение. Диск может выдержать кратковременную компрессионную нагрузку до 250 кг на см квадратный без последствий (до 9000N), но он бессилен против обычного длительного сидения изо дня в день из года в год. В здоровом диске снижение тургора наблюдается уже через 45 минут сидения. В стадии дистрофии диск «проседает» и «распластывается» уже через 20.
Отсюда возникает первая проблема — нарушение обменных процессов в диске при недостаточности диффузии.
Нарушение обменных процессов в диске при недостаточности диффузии
Обменные процессы в клетках зависят от ряда факторов: генетических, прилагаемой физической нагрузки, состояния периферических сосудов и пропускной способности замыкательных пластин.
В процессе жизнедеятельности диски постоянно подвергаются нагрузке, что приводит к частичному разрушению элементов матрикса и необходимости продукции новых аггрекановых комплексов на замену поврежденным.
В здоровом диске постоянно происходит смена анаболической и катаболической фаз. Клетки диска вырабатывают специальные ферменты (энзимы), которые разрушают и уничтожают поврежденные и отработавшие срок структурные элементы. Аггреканазы 1,2 (ADAMTS 4,5) «разрушают» и «растворяют» отработавший дефектный аггрекановый комплекс; матриксные металлопротеиназы (ММР 1,3 и др.) растворяют части поврежденного матрикса. Действие матриксных металлопротеиназ сбалансировано действием фермента-антагониста — тканевого ингибитора матриксных металлопротеиназ (TIMP 1 и 2), который блокирует (подавляет) действие основного «растворителя» и препятствует избыточному разрушению матрикса. TIMP 3 блокирует действие аггреканаз. Смена катаболической и анаболической фазы позволяет в текущем режиме устранять повреждения и проводить «чистку» внутренней среды диска. Т.е. постоянно происходит так называемое гомеостатическое ремоделирование пульпозного ядра.
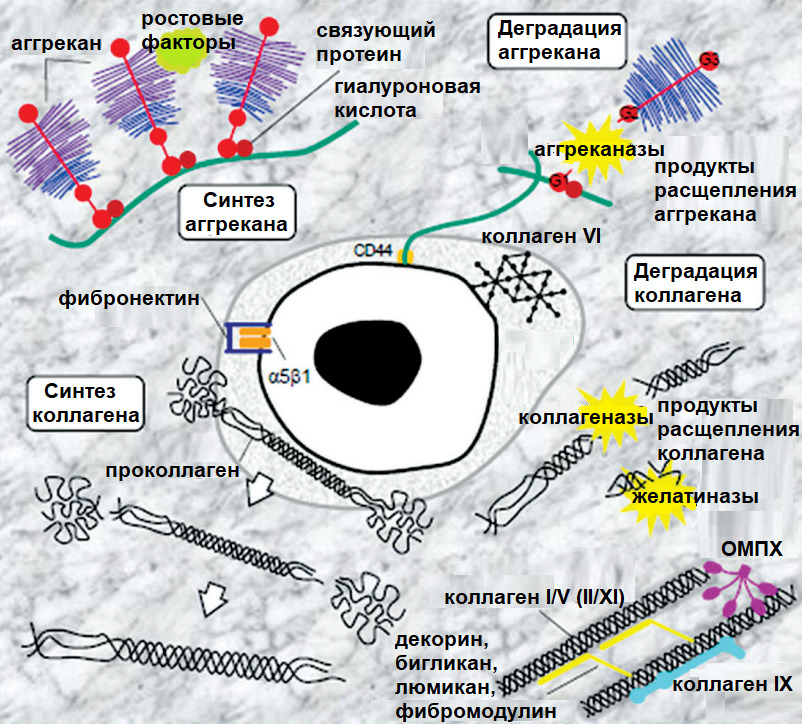
Оптимальной средой для клеточного анаболизма является нейтральная среда. Колебания pH в диске лежат в диапазоне от 7,5 до 5,7. pH здорового диска — 7,1. Максимальный синтез структурных белков при pH 7,0. Клетки пульпозного ядра адаптированы работать в кислой и умеренно ишемической среде. Напряжение кислорода в пульпозном ядре может колебаться в диапазоне от 10% (нормоксия) до 0,5% (критическая гипоксия). Оптимальное для клеток — 1,5—5% (функциональная гипоксия). На периферии фиброзного кольца напряжение кислорода достигает 19%; центр пульпозного комплекса — 0,65%.
Снижение pH до 6,8 — прекращается синтез структурных белков пульпозного комплекса. Снижение pH до 6,5 ведет к дегенерации диска. Рабочий глюкозный диапазон в пределах от 0,8 до 5 mmol/L. Падение уровня глюкозы ниже 0.5 mmol/L больше чем на три дня и снижение pH ниже 6.4 приводит к смерти клеток.
Утрируя: смерть клеток пульпозного ядра — это смерть всего диска.
В природе существует запрограммированная смерть клеток (апоптоз) и регулируемая смерть клеток (пироптоз, некроптоз, ферроптоз).
Смерть клетки вызывается двумя механизмами: внутренним и внешним.
Внутренний путь смерти клетки вызван оксидативным стрессом, стрессом эндоплазматического ретикулума, повреждением ДНК или повреждением митохондрий. Итогом является активация цитозольных белков, отвечающих за апоптоз, с последующей деструкцией ядерных белков и цитоскелета, синтеза «рецепторов смерти», хемокинов (приманок) с целью привлечения и активации клеток, выполняющих фагоцитирующие функции.
Внешний механизм смерти клетки связан с активацией «рецепторов смерти» с помощью «лигандов смерти», синтезируемых клетками иммунной системы.
Для удобства восприятия выделяют три последовательные фазы дегенерации диска: 1) катепсинозависимая дегенерация (макрофагонезависимая), 2) воспалительная макрофагозависимая и 3) репаративная макрофагозависимая фаза. При травме диска дегенерация начинается сразу с воспалительной макрофагозависимой.
К пусковым причинам дегенерации диска относят: ишемию, ацидоз (критическое накопление лактата), прямую травму, оксидативный стресс, стресс эндоплазматического ретикулума, накопление продуктов гликации, метаболические нарушения на фоне генетической предрасположенности.
Ишемия и ацидоз. Катепсинозависимая дегенерация — остеохондроз бухгалтеров, водителей и прочих сидячих профессий. Метаболическое поражение диска.
Самый частый вопрос: «Ничего тяжелого не поднимаю, больших физических нагрузок нет. Почему начала болеть спина и почему появился остеохондроз?». Ответ прост: нарушение обменных процессов в диске, связанное с длительным «стажем» сидения.
Пусковым фактором выступает хроническая критическая ишемия диска вследствие длительного кислородного голодания и «закисания» диска. Снижение напряжения кислорода до 1 — 0,5% и параллельное снижение pH вследствие накопления лактата приводит к ускоренному старению и смерти клеток пульпозного ядра.
Само по себе сидение вызывает очень низкую компрессионную нагрузку, которая не обеспечивает достаточный «помповый» механизм откачки метаболитов.
Для поддержания нормальной жизнедеятельности клеткам нужна энергия. Она производится двумя способами: оксидативное (окислительное) фосфорилирование (с участием кислорода) и гликолиз (без участия кислорода). Другими словами, энергия добывается или «горением», или «брожением». В обильно кровоснабжаемых тканях клетки предпочитают синтезировать энергию с участием кислорода (акцептор электронов), но подобная практика сопряжена с повышенным синтезом побочных продуктов — активных форм кислорода (АФК; Reactive oxygen species, ROS) и оксидативным стрессом, что может привести к повреждению митохондрий и гибели клеток. Обильное кровообращение (соответственно, обмен) позволяет в ускоренном режиме утилизировать побочные метаболиты и/или избавляться от погибших клеток. Межпозвонковый диск является самым крупным бессосудистым органом в теле человека, что жестко детерминирует его метаболизм. Оксидативное фосфорилирование как базовое не подходит в принципе, но кислород и «побочные» метаболиты митохондриального дыхания нужны клеткам как вторичные мессенджеры для запуска и контроля важных сигнальных путей, связанных с жизнедеятельностью клеток. Поэтому 75% энергии в клетке синтезируется благодаря анаэробному гликолизу, 25% — аэробному пути обмена.
За оксидативное энергообеспечение отвечает коактиватор-1α (PGC-1α), за гликолитическое — транскрипционный фактор под названием Фактор, индуцируемый гипоксией (Hypoxia-inducible factor 1-alpha; HIF).
Сам Фактор двухкомпонентный: субъединицы 1 альфа, 2 альфа и 3 альфа и субъединица 1 бета. Соединяясь воедино в ядре клетки, HIF инициирует транскрипцию различных генов в зависимости от «комбинации пары»: 1) HIF-1α + HIF-β; 2) HIF-2α + HIF-β; 3) HIF-3α + HIF-β.
Изоформа HIF-1α является кислородным сенсором клетки и при падении напряжения кислорода ниже 5% связывается с HIF-β, формируют активный HIF, который активирует транскрипционные факторы/гены, чувствительные к гипоксии: NOS2 (Индуцибельная синтаза оксида азота), VEGF (Фактор роста эндотелия сосудов), EPO (эритропоэтин), GLUT1 (глюкозный транспортер), SOX9 (регуляция экспрессии гена коллагена II типа в хондроцитах), IGF2 (инсулиноподобный фактор роста-2), COL2A1 (коллаген II типа) и другие, отвечающие за поддержание жизнедеятельности клетки «на пределе». Данный фактор позволяет работать клеткам в оптимальном гипоксическом диапазоне между 2—5% парциального напряжения кислорода, при котором синтезируется больше всего аггрекана и коллагена II типа. HIF-1α — это мастер-регулятор гликолитического метаболизма клеток при ишемии, который регулирует уровень внутриклеточного (цитозольного) лактата. Это один из факторов, отвечающих за пролиферацию (деление) клеток, дифференцировку незрелых стволовых клеток, поддержание их метаболической активности, синтез коллагена II типа, регуляцию синтеза экстраклеточного матрикса, регуляцию ангиогенеза, регуляцию аутофагии, апоптоз и минерализацию замыкательной пластинки через активацию адаптивных генов.
Изоформа HIF-2α — является катаболическим регулятором и отвечает за активацию генов синтеза матрикс деградирующих энзимов (протеиназ) и провоспалительных медиаторов. Индуцируется фактором некроза опухоли- альфа (TNF-α) и через активацию ядерного фактора κB (NF-κB) запускает синтез ММР-3 и ММР-13, стимулирует оссификацию замыкательной пластинки, блокирует аутофагию в клетках, стимулирует ангиогенез (рост сосудов).
Изоформа HIF–3α является регулятором изоформ HIF-1α и HIF-2α, блокируя их деятельность.
При напряжении кислорода в пульпозном ядре порядка 1—5%, «обобщенный» HIF активирует как сигнальные пути, запускающие анаболические процессы в клетках через активацию генов, отвечающих за синтез аггрекана и коллагена II типа, так и сигнальные пути, запускающие катаболические процессы через активацию генов, отвечающих за синтез интерлейкина-1бета (IL-1β), фактора некроза опухоли — альфа (TNF-α) и т. д. Другими словами, фактор отвечает за баланс анаболических и катаболических процессов (гомеостатическое ремоделирование матрикса пульпозного ядра при гипоксии) и работает по принципу стрелочного перевода на железной дороге.
При падении напряжения кислорода ниже 1% (критическая гипоксия) фактор HIF активирует только катаболические пути и, по сути, являясь химическим детонатором воспалительной реакции в диске, итогом которой будет смена фенотипа («старение» клеток) или апоптоз клеток (смерть) с последующими дегенеративными процессами в матриксе диска. Длительная пороговая гипоксия (0,5 — 1%) вызывает «перебор» по синтезу HIF фактора, который в том числе активирует гены, ответственные за синтез фактора роста эндотелия сосудов (VEGF). Это компенсаторная реакция, направленная на восстановление дыхательного гомеостаза пульпозного комплекса за счет стимула врастания капилляров внутрь диска.
Нарушение синтеза HIF может привести к смерти клеток из-за обратного процесса — выраженного повышения парциального напряжения кислорода на фоне повышения уровня глюкозы (нарушена взаимная балансировка по оси «HIF-PGC-1α»). При таком анаболическом раскладе резко повышается производство энергии митохондриями по оксидативному (!) типу с быстрым накоплением перекисей и дальнейшим оксидативным стрессом. Клетки пульпозного ядра предпочитают работать в умеренно ишемической среде за счет гликолитического окисления углеводов и жиров («брожение»). Это снижает количество утечек электронов из дыхательной цепи (в норме только 0,2 — 2%) и уменьшает объем синтезируемых активных форм кислорода (АФК), предотвращая оксидативный стресс.
Другой процесс. Перебор по синтезу HIF-1а приведет к блокировке PGC-1α, который отвечает за митохондриальный генез (фрагментация митохондрий и их «склеивание» с увеличением размера и дыхательного потенциала за счет увеличения крист). PGC-1α отвечает за активацию генов, ответственных за лизис («растворение») поврежденных митохондрий, накопление которых также вызывает оксидативный стресс за счет высокой утечки АФК. Митохондрии лучше представить как «клетка в клетке». Повреждение большого количества митохондрий для клетки крайне нежелательно. Полная блокировка работы PGC-1α приведет к накоплению митохондриального мусора и спровоцирует гибель клетки из-за переизбытка вовремя не утилизированных «фрагментов» и активных форм кислорода (АФК).
АФК являются разновидностью нестабильных и высокоактивных молекул, включая гидроксильный радикал (ОН-); супероксид-анион (O2–); перекись водорода (H2O2); оксид азота (NO) и гипохлорит-ион (OC1-). Они образуются как побочные продукты клеточного аэробного метаболизма и являются важными внутриклеточными сигнальными молекулами, участвующими в регуляции различных физиологических процессов в клетках. Но это если речь идет о нормальном (допустимом) их количестве. Под оксидативным стрессом подразумевают комплексное повреждение органелл клетки и структурных биомолекул. При избыточном производстве и накоплении, активные формы кислорода встраиваются в молекулы и приводят к повреждению внутриклеточных протеинов, нуклеиновых кислот, мембранных липидов и углеводов. Чисто механически, АФК просто химически «ломают» молекулы, превращая их в клеточный «мусор». Или что еще хуже — изменяют их конформационные свойства за счет образования новых патологических структурных молекул. Наиболее подвержены повреждению серосодержащие аминокислоты цистеин и метионин, что приводит к банальному распаду белков. Оксидативный стресс может вызывать агрегацию (соединение) протеинов и превращать их в цитозольный «патоген» (аутоантиген). Например, окисленные белковые продукты (advanced oxidative protein products (AOPPs) могут активировать сигнальный путь MAPK и запускать апоптоз. При оксидативном повреждении липидов образуются активные формы карбонила (reactive carbonil species) — которые повреждают как сами липиды (мембраны/оболочки), так и протеины, нуклеиновые кислоты. Активные формы карбонила способствуют образованию конечных продуктов гликирования (Advanced glycation end products (AGEs) — «склеившиеся» белки или липиды в результате воздействия сахаров. «Засахаренные» молекулы крайне опасны для организма. Они приводят к митохондриальной дисфункции, нарушая работу митохондриальных пор, что вызывает снижение уровня синтеза белка Bcl-2 (антиапоптического белка), контролирующего проницаемость мембран, и активацию Bax — белка, увеличивающего проницаемость митохондриальной мембраны и стимулирующего запуск апоптоза.
АФК ломают молекулы ДНК, что вынуждает клетки «стопорить» деление вследствие нежелания воспроизводить свои «дефектные» копии. Также активные формы кислорода повреждают сами митохондрии (разрыв оболочки), что приводит к нарушению их работы и запускает каскад цепных реакций, приводящих к старению клетки или ее смерти. Здоровые клетки способны препятствовать накоплению АФК через активацию редокс («очистных») систем (синтез супероксид дисмутаз, каталаз и глутатиона; Nf2 зависимые гены). Нарушение оксидативно-восстановительного статуса при дегенерации МПД с одной стороны проявляется в виде увеличения продукции АФК, с другой стороны — снижением синтеза и активности антиоксидантных веществ.
Поэтому поддержание выживаемости клеток при низком pH и низком напряжении кислорода зависит от способности клеток синтезировать и вовремя утилизировать HIF-1α (фактор, индуцируемый гипоксией — 1 альфа) и PGC-1α (коактиватор-1 альфа).
HIF-1α напрямую влияет на метаболизм глюкозы: регулирует работу глюкозных транспортеров GLUT1, GLUT3 и GLUT9, ответственных за доставку глюкозы в клетку. Фактор поддерживает лактатный гомеостаз клеток и не позволяет им «перекисать», «стареть» и гибнуть. Также влияет на процесс митофагии (устранения поврежденных митохондрий). HIF-1α блокирует Fas-рецептор («рецептор смерти»), тем самым защищая клетки от Fas-лиганд опосредованного апоптоза при атаке иммунными клетками. Активность фактора связана с циркадными ритмами и напряжением кислорода. Высокое напряжение кислорода (6—10% при врастании капилляров) деактивирует субъединицу HIF-1α и не позволяет ей смещаться в ядро клетки, связываться со своим «напарником» HIF-1β, формировать активную форму и активировать транскрипцию нужных генов. HIF циркадно зависимый от протеинов «циркадных часов». Чтобы фактор синтезировался, нужен полноценный сон. У людей, работающих на ночных сменах, боль в спине встречается чаще.
Сигнальные пути HIF и NF-κB пересекаются, что объясняет связь ишемии с дальнейшим воспалением. Одной из главных задач фактора является синтез белков-насосов, откачивающих лактат за пределы клетки. Для удаления излишка, ранее «откачанный» в межклеточный матрикс лактат должен быть выведен из диска при помощи диффузии (порядка 8 часов от центра пульпозного ядра). В норме при полноценной диффузии все продукты клеточного метаболизма успешно выводятся из диска и утилизируются. Качество диффузии зависит от регулярной длительной ходьбы и 8-часового сна (ночная «очистка» диска). «Хроническое» сидение как раз и нарушает «помповый» механизм откачки лактата. При сидении нагрузка на диск 0,2 МРа, поэтому она и относиться к катаболической.
Параллельное повышение внеклеточного невыведенного лактата является ключевым механизмом, усиливающим дегенерацию диска при межпозвонковом остеохондрозе: на мембранах клеток пульпозного ядра и замыкательной пластинки находятся рецепторы, чувствительные к закислению (Acid sensing ion channel; ASIC1 и ASIC3). Это универсальные вольтаж — независимые ионные каналы, которые выполняют множество функций в организме. При умеренном pH 7,0 рецепторы «заблокированы». По мере усиления ацидоза (закисания пульпозного комплекса) рецепторы активируются протонами водорода Н+, которые перекачиваются через мембраны митохондрий и накапливаются при синтезе АТФ. При утечке через поврежденные мембраны протоны в избытке появляются в цитозоле клетки. Затем выбрасываются клетками в межклеточное пространство. Высокие уровни лактата усиливают чувствительность ASIC к протонам водорода.
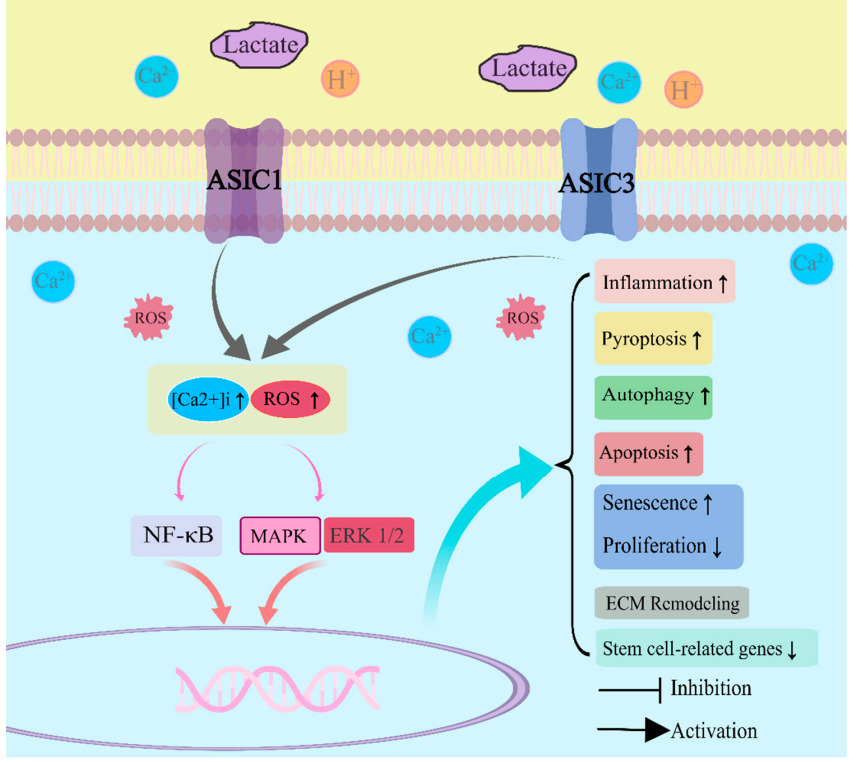
Активация ASIC1 в хондроцитоподобных клетках приводит к резкому повышению внутриклеточного кальция Ca2+, что вызывает митохондриальную дисфункцию и эндоплазматический стресс, итогом которого будет оксидативное стресс-индуцированное старение клеток, апоптоз или пироптоз вследствие активация сигнального пути ядерного фактора κB (NF-κB), увеличение синтеза провоспалительных цитокинов, аггреканаз и металлопротеиназ. Рецептор ASIC3 в отличие от других типов кислотночувствительных рецепторов работает с некоторой задержкой закрытия, которая увеличивается по мере закисания ткани. Чем более кислая среда, тем дольше рецептор открыт и больше пропустит кальция в клетку.
Эта же судьба и хондроцитов замыкательной пластинки. ASIC3 работает в паре с фактором, индуцируемым гипоксией-1α (HIF-1α), и регулирует адаптационные возможности клеток к гиперосмотической среде в условиях умеренного ацидоза. Выраженное скисание диска приводит к компенсаторному увеличению количества рецепторов ASIC3 на мембране, что увеличивает количество входящего Ca2+. Дальше дегенерация развивается по двум сценариям:
Первый. Постепенная декомпрессия диска вследствие снижения осмотического давления. Умеренное, но затяжное течение.
Аггрекан является основным протеогликаном, имеющим критическое значение для поддержания осмотического давления (оптимального тургора диска). Осмолярность экстраклеточного матрикса в течении дня колеблется в пределах от 430 до 496 mOsm единиц, что требует подстройки метаболических процессов под разное давление. Обменные процессы в клетках зависят от осмочувствительного транскрипционного фактора (TonEBR, tonicity-responsive enhancer binding protein), который регулирует работу: 1) аквапоринов (AQP — 1 AQP — 5), рецепторов, пропускающих в клетку воду и кислород; и 2) осмо-, и механочувствительных ванилоидных рецепторов переходного потенциала TRPV4, которые регулируют синтез коллагенов. При низком осмотическом давлении TRPV4 активируют гены провоспалительных цитокинов IL-1β и IL-6.
Быстрое разрушения матрикса и аггрекана приводит к снижению осмотического давления и увеличению синтеза IL-1β и IL-6 резидентными клетками. Позвоночно-двигательный сегмент с «просевшим» диском начинает усиленно «ерзать». Каждое движение сопровождается увеличением линейного сдвига вышележащего позвонка над нижележащим с увеличением нагрузки на фиброзное кольцо. Механочувствительный рецептор TRPV4 является рецептором, специализирующемся на тракции (растяжении) и первым отреагирует на подобную нагрузку. Правда, отреагирует специфически через активацию NF-κB и усиленным синтезом провоспалительных цитокинов, что усугубляет разрушение диска через патологическое ремоделирование матрикса. Параллельно синтезируемые клетками катепсины K, D, L и сериновые протеазы, выбрасываемые в межклеточное пространство, не только стимулируют усиленную выработку соседними клетками матриксных металлопротеиназ (MMP), но и при этом блокируют действие их тканевого ингибитора (TIMP), таким образом, многократно усиливая катаболическое (разрушающее) действие металлопротеиназ в расщеплении матрикса. Поэтому такую дегенерацию еще обозначают как катепсиновая или «макрофагонезависимая дегенерация», т.е., без привлечения клеток иммунной системы при повреждении диска. Интерлейкин-6 (IL-6) «позаботится» о ремоделировании лимбуса и формировании остеофитов.
Второй сценарий (более агрессивный) развивается, если не предпринять меры по стабилизации сегмента и восстановления нормального pH.
Механический стресс приводит к быстрому накоплению АФК, последующему повреждению митохондрий и эндоплазматического ретикулума, что закономерно приводит к активации сигнального пути ядерного фактора κB (NF-κB), который активирует гены, отвечающие за сборку инфламмасом. Инфламмасомы (англ. inflammasome от англ. inflammation — воспаление) — самособирающийся пул цитозольных белков, отвечающих за активацию воспалительного ответа через синтез и секрецию провоспалительных цитокинов интерлейкина-1β (IL-1β) и интерлейкина-18 (IL-18). IL-18 в клетках пульпозного ядра стимулирует сигнальный путь каспазы-3/9, способствуя апоптозу клеток и деградации экстраклеточного матрикса. Вне зависимости от типа патологического сигнала, клетка начинает заранее готовиться к воспалению и синтезирует адаптерные белки с доменами для пирина и прокаспазы-1 (неактивная форма каспазы). Плюс начинает синтезировать запасы предшественников интерлейкинов-1/-6/-8/-12. Каспаза 1 отвечает за клеточный иммунитет и является активатором интерлейкина-1β — главного воспалительного цитокина. Некоторое время клетка буквально складирует «заготовки» белков, ответственных за воспаление. В фазу подготовки к сборке инфламмасомы входит «накопление» кальция Ca2+ в цитоплазме, митохондриальная дисфункция, «накопление» активных форм кислорода, постепенное разрушение органелл (лизосом). Если любой патологический сигнал имеет достаточную силу/концентрацию или длится достаточное время, происходит сборка инфламмасомы с активацией каспазы-1, которая, в свою очередь, неактивные формы интерлейкина-1β переводит в активные. Также каспаза-1 активирует «спящий» белок гасдермин D c разделением его на активные формы C и N. Фрагмент гасдермина N соединяется с мембранными белками клетки и образует большие поры («дыры»), через которые наружу выбрасываются калий (К+), цитокины и IL-1β с одновременным резким входом воды. Клетка разбухает и буквально взрывается как «бешеный огурец», выстреливая провоспалительные цитокины во все стороны. Критическое (ниже 6,5 pH) скисание пульпозного ядра или резкий вход кальция с одновременным выходом калия вызывает прямую активацию инфламмасомы NLRP3 без задержек. Активация соседних клеток интерлейкином-1β и 18 приводит к выраженному усилению синтеза матриксных металлопротеиназ и аггреканаз.
Круг замкнулся: пироптозная смерть одних клеток запускает цепную реакцию с последующим быстрым «схлопыванием» диска.
Особенно опасна гиперактивность ASIC1. Это рецептор со специализацией по хондроцитам замыкательной пластинки. Его повышенная «деятельность» приводит к гибели хондроцитов и появлению дефектов в пластинке и просачиванию жидкой фракции пульпозного комплекса в тело позвонка. Причем этот «коктейль» крайне токсичен в силу большого содержания провоспалительных цитокинов. Это одна из причин воспаления в субхондральной части кости (изменения по Модику 1).
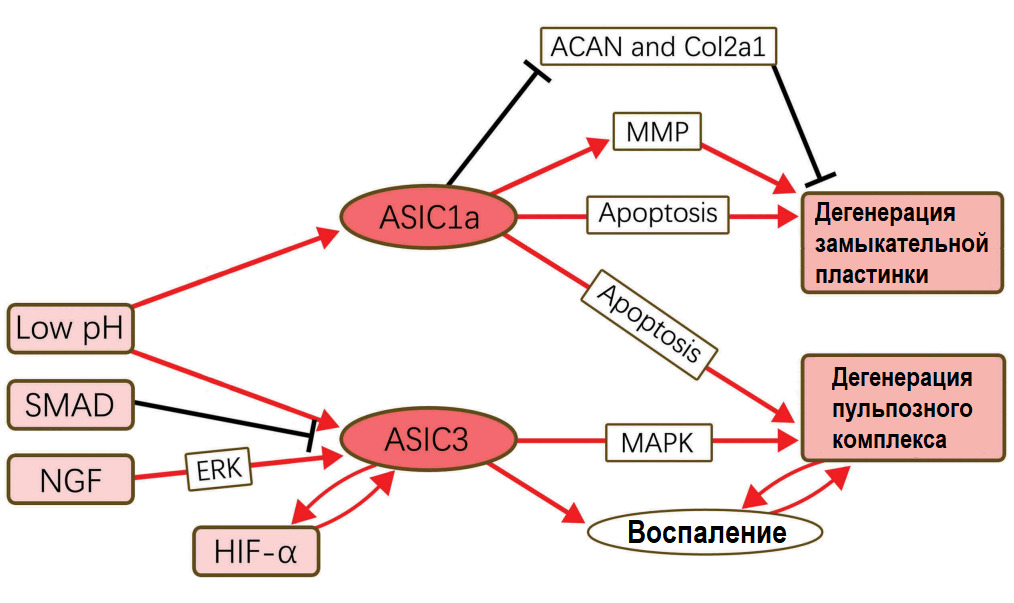
Интерес представляет собой генетический механизм защиты тканей от самоуничтожения: когда клетка «понимает» что ее деятельность угрожает целостности ткани, то она «жертвует» своей жизнью ради сохранения популяции здоровых и полноценных клеток и переходит в режим контролируемой «самоликвидации» по сценарию, не угрожающему соседним клеткам. Но очень часто предъявляемые нагрузки настолько критичны, что смерть наступает не от апоптоза, а от пироптоза: стимулов «смерти» настолько много, что клетку буквально «разрывает» от внутренних деструктивных химических процессов.
При апоптозе клетка «схлопывается», «скукоживается» и сжимается. Умирает тихо, мирно и под контролем внутриклеточных генетически обусловленных механизмов, регулирующих запрограммированную смерть клеток. Нет выброса ядерных белков в межклеточное пространство. В норме апоптоз не сопровождается воспалительной реакцией соседних клеток.
Критическая проблема санации пульпозного комплекса — невозможность быстрого и качественного удаления мертвых клеток вследствие отсутствия кровоснабжения диска и иммуннопривилегированности пульпозного комплекса. Соответственно, у макрофагов (профессиональных «чистильщиков») нет прямого доступа к «трупам». В норме в васкуляризированных тканях утилизация апоптозных «трупов» осуществляется за счет фагоцитоза, который обеспечивает минимальный риск попадания клеточного содержимого в межклеточное пространство. Нормальный фагоцитоз может быть обеспечен только резидентными или циркулирующими макрофагами. Умирающая клетка на последнем этапе жизни «сигнализирует» макрофагам с помощью хемокинов о необходимости ее поглощения и утилизации. Макрофаг захватывает клетку, перемещает ее в лизосому (внутренний центр «переваривания»), таким образом, предотвращая случайный выброс внутриядерных белков в межклеточное пространство. Если апоптическая клетка долго не захватывается макрофагами, то она подвергается разрушению различными энзимами/протеазами, что приводит к выбросу ядерных белков в межклеточное пространство. А это плохо… В пульпозном ядре диска нет своих (резидентных) специализированных макрофагов. Клетки сами по мере своей возможности занимаются фагоцитозом, что критически влияет на скорость обнаружения и захват мертвых клеток. Апоптоз быстро превращается в некроз, что может спровоцировать воспаление.
Смерть клетки пироптозом — воспалительная смерть — это разбухание с последующим ее разрывом вследствие патологических внутриклеточных процессов из-за вхождения большого количества воды через образовавшиеся патологические поры в мембране. И с дальнейшим вовлечением соседних клеток, отвечающих воспалительной реакцией на это событие. Большое количество одновременно погибших клеток в результате пироптоза может спровоцировать масштабное воспаление в диске. Как правило, пироптоз вызван или критическим скисанием диска (водители — дальнобойщики) или оксидативным стрессом в результате механической перегрузки диска. Просидел 8 часов в офисе, диски поскисали, затем поехал в тренажерный зал и потаскал штангу. Убойная комбинация: «скисший и просевший диск плюс повышенная механическая нагрузка» — комбо! Критически низкое pH, повышенное количество перекисей в цитозоле, компрессия, превышающая нагрузку в 1,3 MPa и активация интегринов-бета 1 через оксидоредуктазу (LOX) приводят к активации сигнального пути p38 MAPK, вследствие чего резко увеличивается активация синтеза металлопротеиназ (MMP-3/13), аггреканаз (ADAMTS-4/5), белков старения (р21, р53 и р16) и смерти (каспаза 3,9). Можно сразу в пироптоз! Клетки хлопают как попкорн.
Некротизированные и стареющие естественным путем клетки всегда присутствуют в ткани диска, но в норме их количество не выходит за критический предел. Их катаболическая деятельность компенсирована анаболической активностью здоровых и молодых клеток.
И если жизненный цикл здоровой клетки заканчивается апоптозом — естественной (но зачастую принудительной) генетически запрограммированной смертью клетки, то «голодающие» и перегруженные клетки не умирают — они перестают выполнять свою анаболическую функцию и делиться — воспроизводить самих себя, синтезировать структурные белки матрикса и продуцировать аггрекан. Говорят о смене фенотипа — клетка «постарела».
Понятие старения клеток не является некой философской абстракцией, а вполне себе лабораторно выявляемое состояние жизненного цикла клетки. Для любознательных: к маркерам стареющих клеток относят повышение экспрессии белков-регуляторов клеточного цикла p16INK4A и p21Cip1, и такие факторы секреторного фенотипа, связанного со старением (Senescence-associated secretory phenotype; SASP), как интерлейкины-6 и 8 (IL-6, IL-8), моноцитарный хемоаттрактантный белок-1 (MCP-1), плазминоген активируемый ингибитор-1 (Pai-1), β-галактозидаза, ассоциированная со старением (SA-βgal), участки теломер-ассоциированных и нетеломерных повреждений ДНК.
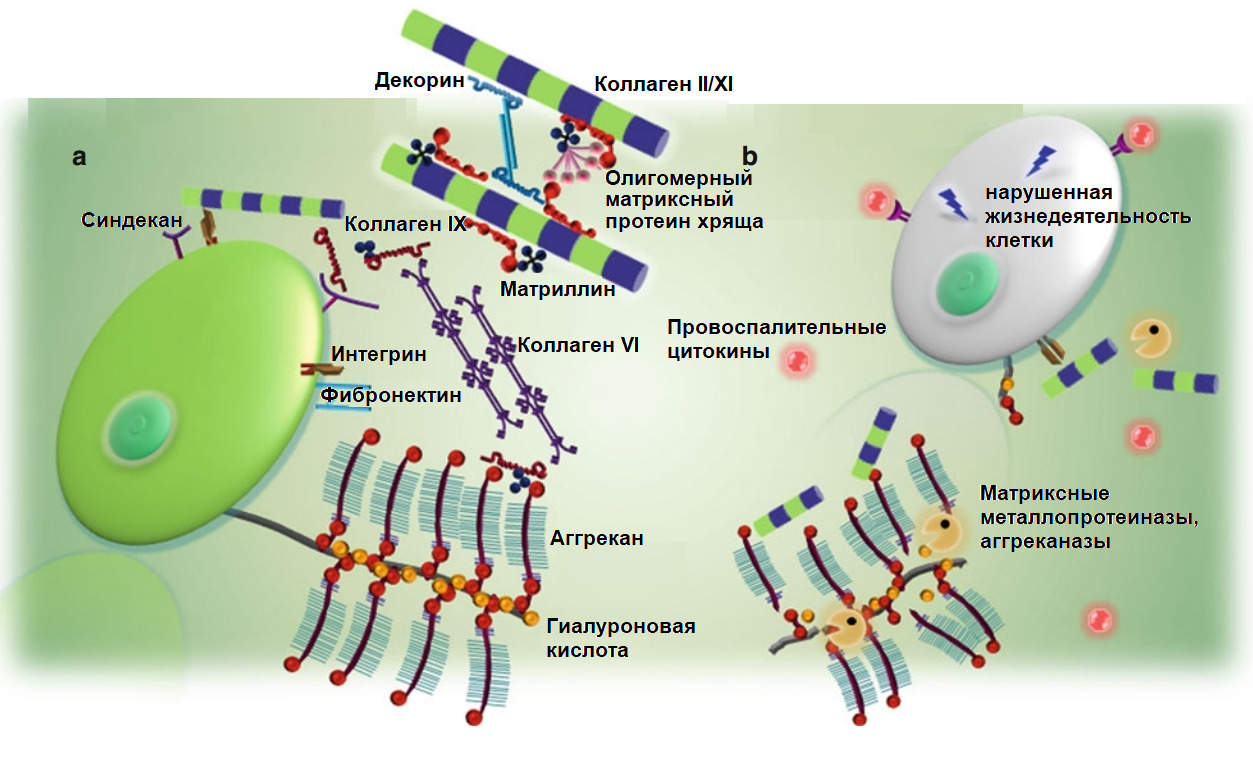
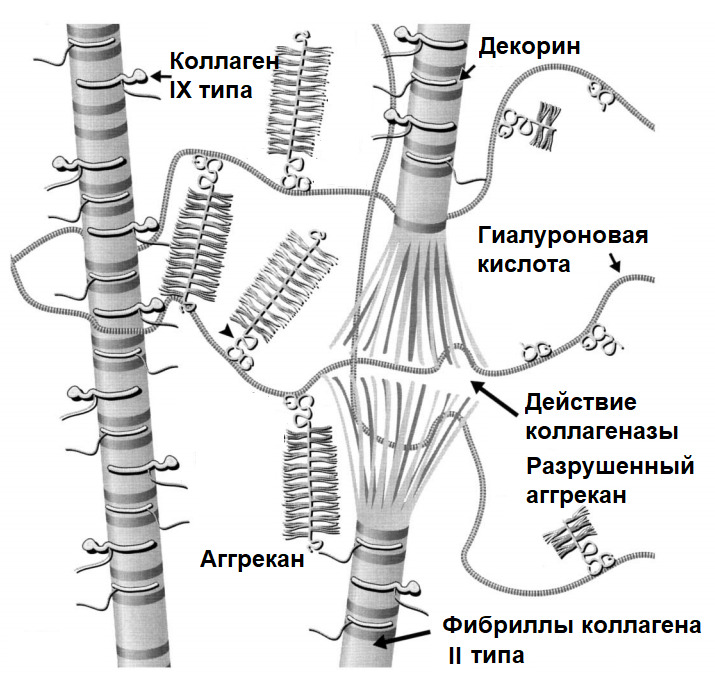
Несмотря на свою «дряхлость» клетка остается активна катаболически: вырабатывает фактор некроза опухоли-альфа (TNF-α), IL-1β, IL-6, IL-8, хемокины и Фактор некроза опухоли–подобный легкий индуктор апоптоза (TNF-like weak inducer of apoptosis; ТWEAK). Это аналог TNF-α, только низкоконцентрированный. Такое себе низкогредиентное отравление окружающих втихаря…. «Старая» клетка гадит исподтишка своим коллегам по цеху и мстит хозяину диска за невыносимые условия жизни и работы.
Но есть нюанс. Даже среди старых клеток существуют свои разновидности (фенотипы). Часть клеток доживает до старости естественным путем (достигается предел деления по Хейфлику), часть стареет ускоренно под воздействием внешних стимулов (Stress-induced premature senescence; SISP). Это физическое принуждение к старению вполне себе здоровых полноценных клеток, поэтому такое «старение» агрессивное и с далеко идущими последствиями. Планово постаревшая клетка (SASP фенотип) имеет низкую секреторную активность, принудительно постаревшая (SISP фенотип) — высокую. Плюс генетическая обремененность. Спондилез и остеохондроз как показательный пример.
Ускоренная «убыль» и так незначительной популяции клеток пульпозного ядра сказывается на резком уменьшении синтеза коллагена II типа и аггрекана. Компенсаторной реакцией оставшихся и часто «голодающих» клеток будет синтез коллагена I типа как попытка выполнить работу «за себя и того парня». Вместо хондроитин сульфата клетки начинают вырабатывать кератансульфат, версикан, фибронектин, декорин, бигликан, фибромодулин и прочие структурные белки, слабо удерживающие воду, что приведет к дальнейшему снижению тургора диска (снижение осмотического давления), его проседанию, распластыванию и фибротизации.
В отличие от спондилеза развитие остеохондроза в значительной степени зависит от генетической предрасположенности. Вклад генетики составляет от 35 до 77%. Для спондилеза характерна «затяжная» аутофагия и апоптоз клеток, для межпозвонкового остеохондроза — пироптоз.
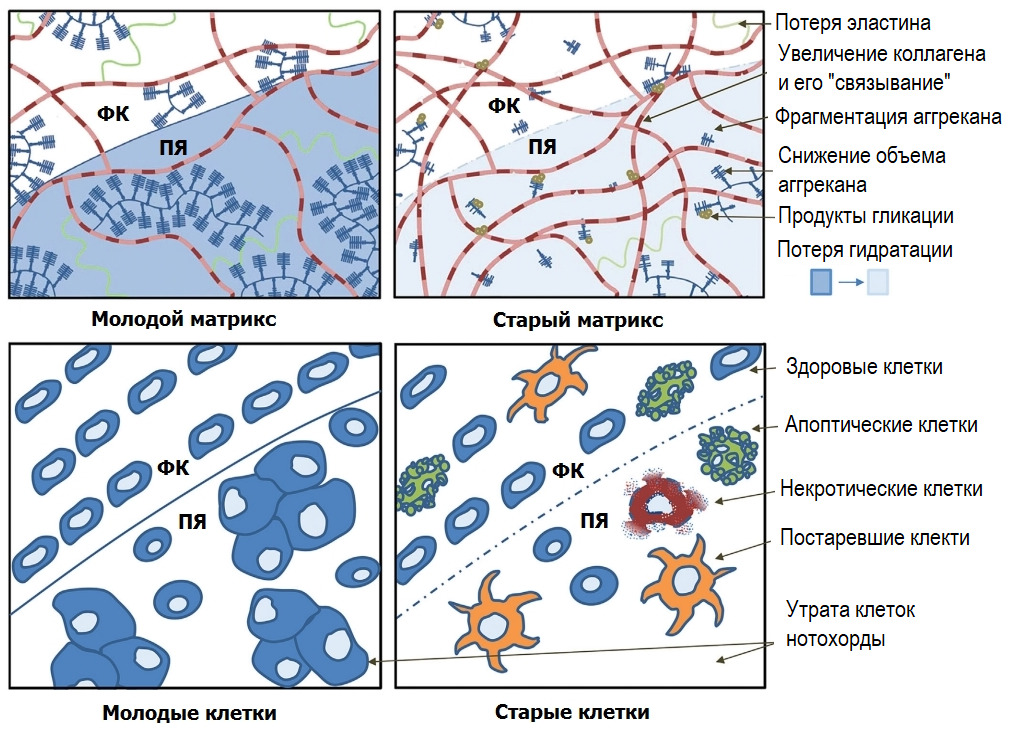
В отличие от спондилеза, где максимальная потеря высоты диска не превышает 30%, остеохондрозный диск — это диск, который уже потерял, как минимум, 40% своей высоты.
Шмидт И. Р. в статье «Решенные и нерешенные проблемы вертеброневрологии на современном этапе развития науки» (2004) писала:
«Клинико-генеалогическими и генетико-математическими исследованиями установлено, что остеохондроз позвоночника (ОП) — это мультифакториальное заболевание с наследственной предрасположенностью. При этом, генетическая компонента составляет 80%, средовая — 20%. В результате взаимодействия генетических и средовых факторов в населении возможны 3 варианта: 1 — нет ОП, 2 — ОП без неврологических проявлений, 3 — развитие неврологических проявлений остеохондроза позвоночника».
Мунир с соавт. (2018) дают данные схожие с данными Шмидт:
«[исследование Самбрук (1999), близнецы, преимущественно женщины)]. Они сообщили о роли наследственности в 76% для поясничного отдела позвоночника и 73% для шейного отдела позвоночника, что удивительно высоко для патологии, которая ранее считалась профессиональной (средовой) по своей природе».
Данилов Ан. Б. и Данилов Ал. Б. в статье «Дискогенная боль» (2019) со ссылкой на Писолд озвучивают цифры: «Определенную роль (а по некоторым данным, от 52 до 74% случаев боли в спине отводят генетическим факторам».
В то же время Адамс и др. (2010) акцентируют внимание на том, что: «Генетические факторы играют важную роль в старении и дегенерации дисков, но их влияние не должно быть преувеличено. Недавние исследования близнецов показывают, что вклад наследуемости дегенерации диска составляет 29–54%, при этом дополнительные влияния окружающей среды (46–71%) варьируются в зависимости от уровня позвоночника (Battie et al., 2008)».
Попелянский Я. Ю. (2003) писал: И. Р. Шмидт с соавт. (1977) отметила экзогенные влияния в 84% со следующей конкретизацией: (смотри таблицу «Провоцирующие факторы у больных остеохондрозом позвоночника»).
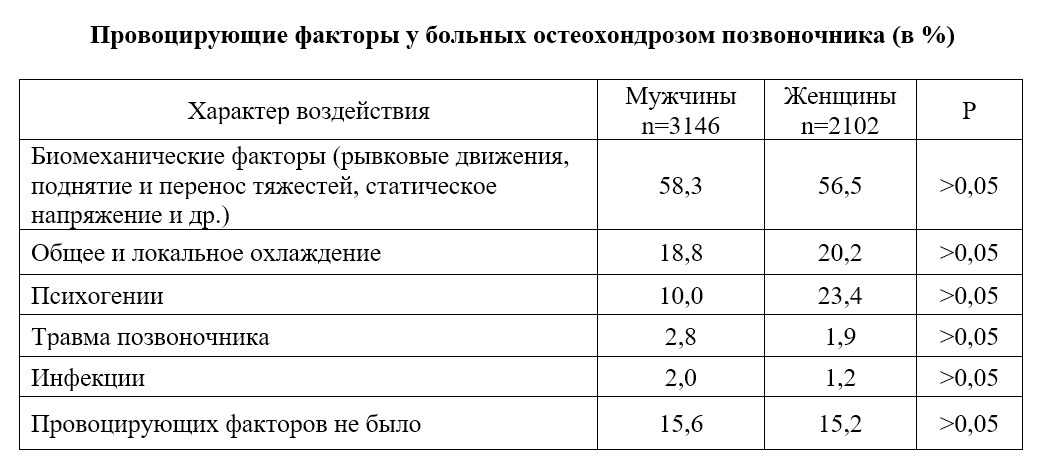
«На первом месте оказались механические воздействия, но они нередко представляли собою обычные жизненные ситуации, которые до данного заболевания многократно повторялись без каких-либо вредных последствий. Лишь у 20% больных имели место чрезмерные нагрузки: поднятие или перенесение больших тяжестей, антифизиологичная поза, тяжелые стрессовые ситуации и др. Из них неблагоприятные механические факторы встречались немногим более чем у половины больных.
<…> Гипотеза о зависимости между характером профессиональной деятельности и распространенностью остеохондроза позвоночника была отвергнута статистическим анализом».
К схожему выводу пришли и Хеманта с соавт. (2016): «профессиональные факторы имели умеренное влияние (от 2% до 15%) на развитие дегенеративной болезни диска по сравнению с генетическими влияниями (от 47% до 66%)».
С полиморфизмом (вариабельностью; разные варианты кодирования, определяющие основные свойства) генов, кодирующих рецептор витамина D, связаны такие процессы в диске как: повышенное обезвоживание [высыхание] диска, повышение выпячивания и снижение высоты диска, повышение разрывов и трещин фиброзного кольца, повышение роста остеофитов.
С дефицитом витамина D связаны многие заболевания скелетно-мышечной системы. Снижение поступления витамина приводит к уменьшению синтеза его рецептора VDR, снижению синтеза инсулиноподобного фактора роста-1 (IGF-1), коактиватора-1α (PGC-1α), протеинкиназы С (AKT), увеличению накопления АТФ и активации сигналинга FOXO3 с последующей транскрипцией генов Atrogin-1, что приводит к деградации мышечных белков и атрофии мышц. Особенно часто жертвами дефицита витамина D становятся женщины, поскольку у них данный витамин регулирует в 3 раза больше количество генов, чем у мужчин.
С полиморфизмом генов, кодирующих матриксную металлопротеиназу-3 (ММР-3; Stromelysin-1) связана более выраженная дегенерация диска.
Также патология связана с полиморфизмом генов, кодирующих коллаген IX типа, который является связующим белком матрикса.
Полиморфизм данных генов имеет выраженную ассоциацию с дегенеративным заболеванием диска и не зависит от расовой и половой принадлежности.
Один человек может полжизни проработать грузчиком и не иметь проблем со спиной, другой пару лет просидит в офисе и инвалидизируется по данному заболеванию.
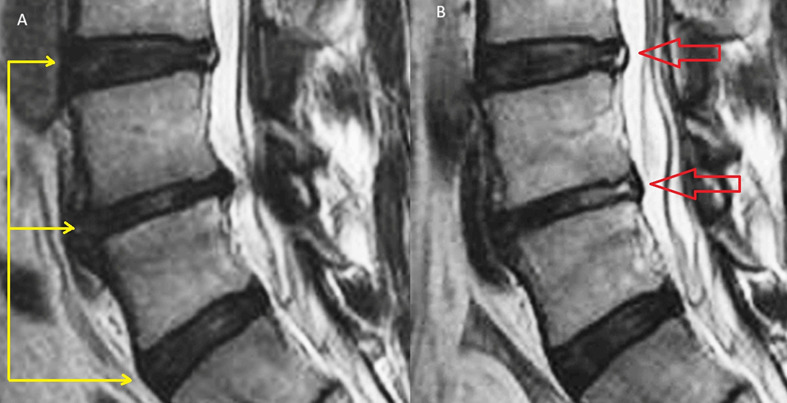
Тагер И. Л. и Мазо И. С. (1979) приводят данные Косинской Н. С., которая при обследовании 870 позвоночников выявила межпозвонковый остеохондроз только в 15,8% случаев. Манчиканти Л. озвучивает схожие данные: от 16 до 26%. Причем согласно Сантьяго (Santiago et al., 2020) со ссылкой на Резника в 19% случаев рентгенологически подтвержденный межпозвонковый остеохондроз никак себя клинически не проявляет. Поэтому и существует такое понятие как неврологические синдромы остеохондроза позвоночника, причем само понятие остеохондроз позвоночника — это концептуальный собирательный термин, указывающий на синергизм дегенеративной болезни диска, спондилоартрита/спондилоартроза, часто миозита, сопутствующей нестабильности в ПДС, суммы данных патологических процессов, приводящих к стенозу позвоночного канала, и обязательно с вовлечением нервной системы. Остеохондроз позвоночника — это не клинический диагноз. Это обобщающий термин, описывающий дегенеративное заболевание позвоночника, а не его естественное старение (спондилез).
Межпозвонковый остеохондроз (или просто остеохондроз) — это рентгенологический диагноз, а не диагноз терапевтов или семейных врачей, который они выставили «на глаз» на основании жалоб пациента. Клиницисты в диагнозе должны указывать синдром остеохондроза, а не констатировать факт его наличия, списывая с заключения рентгенолога.
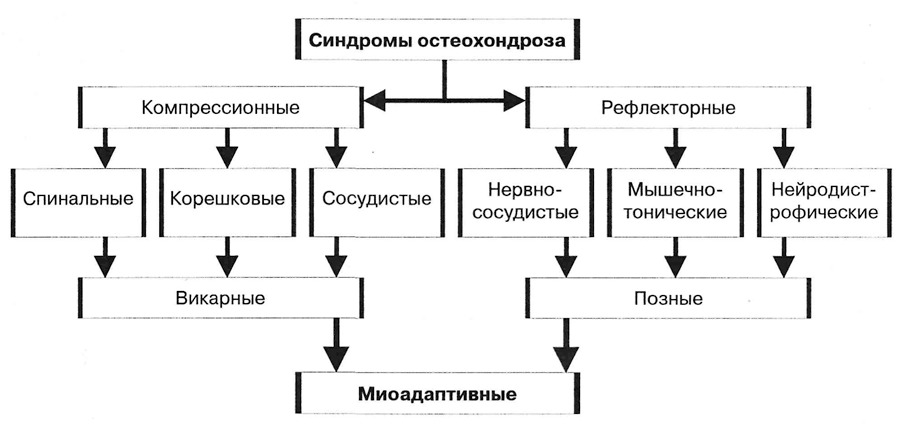
Соответственно, в старой советской литературе описывались синдромы или неврологические проявления остеохондроза.

Кипят споры по поводу того, знают ли за рубежом «советский» остеохондроз. Да, знают. Во всех радиологических (рентгенологических) классификациях дегенеративные изменения диска подразделяют на возрастные, как правило, бессимптомные (спондилез) и ускоренную, агрессивно протекающую дегенерацию (межпозвоноковый остеохондроз). Другими словами, разделяют на доброкачественную и патологическую дегенерацию. Причем в зарубежных научных статьях и монографиях авторы по поводу терминологии особо не заморачиваются и взаимозаменяемо употребляют два варианта: «intervertebral osteochondrosis/межпозвоноковый остеохондроз» или просто «osteochondrosis».
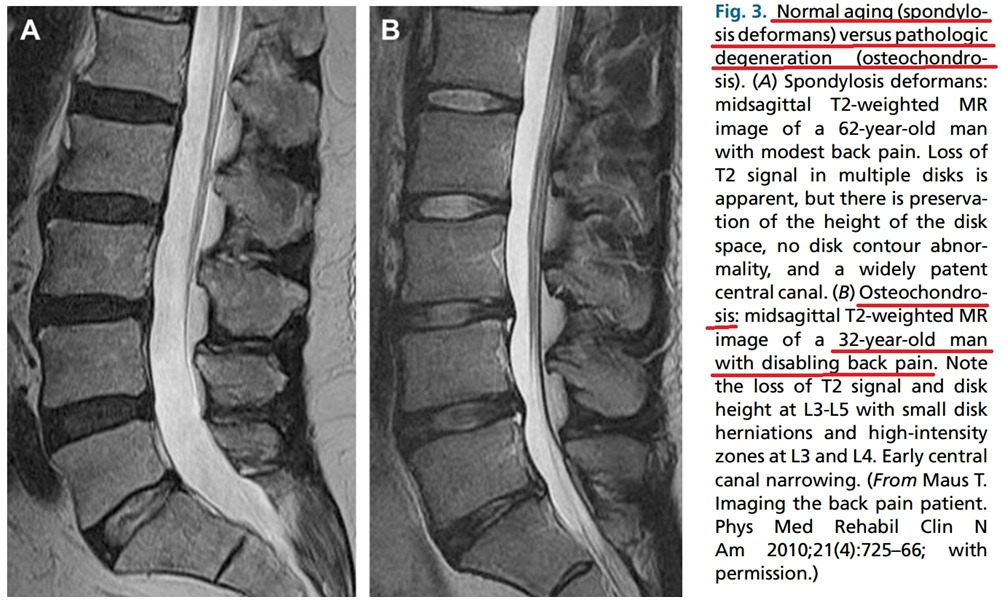

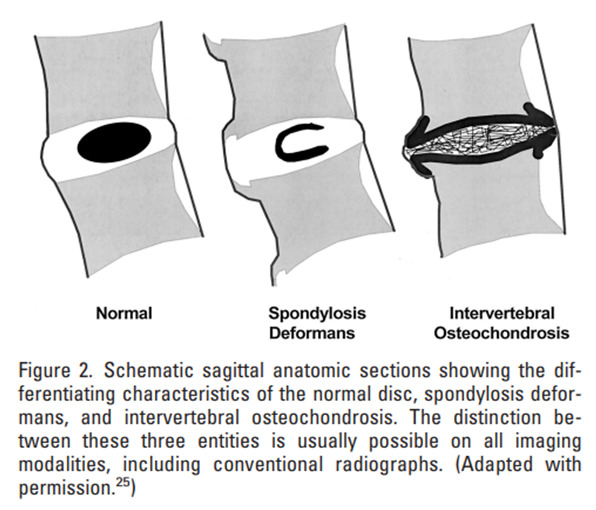
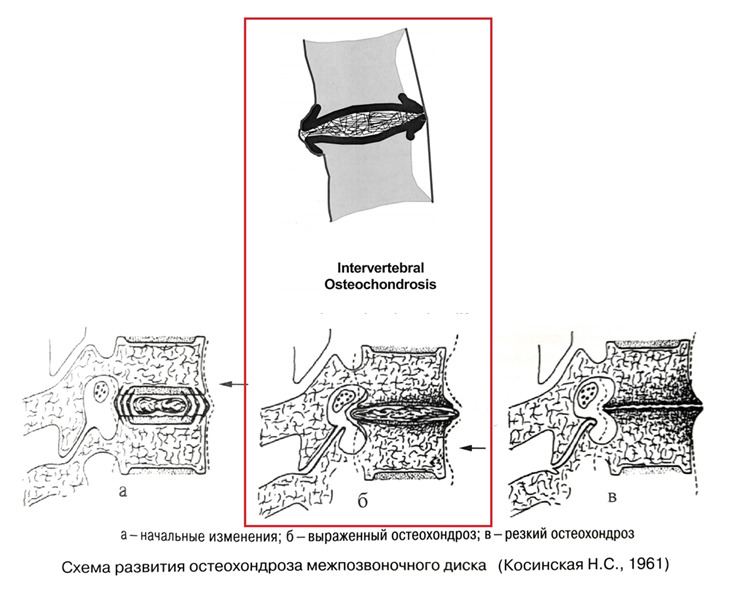
От противников концепции остеохондроза позвоночника часто можно слышать абсурдные заявления, что остеохондроза на МРТ или рентген изображении «не видно». Не знаю, кому как, но, по-моему, видно прекрасно.
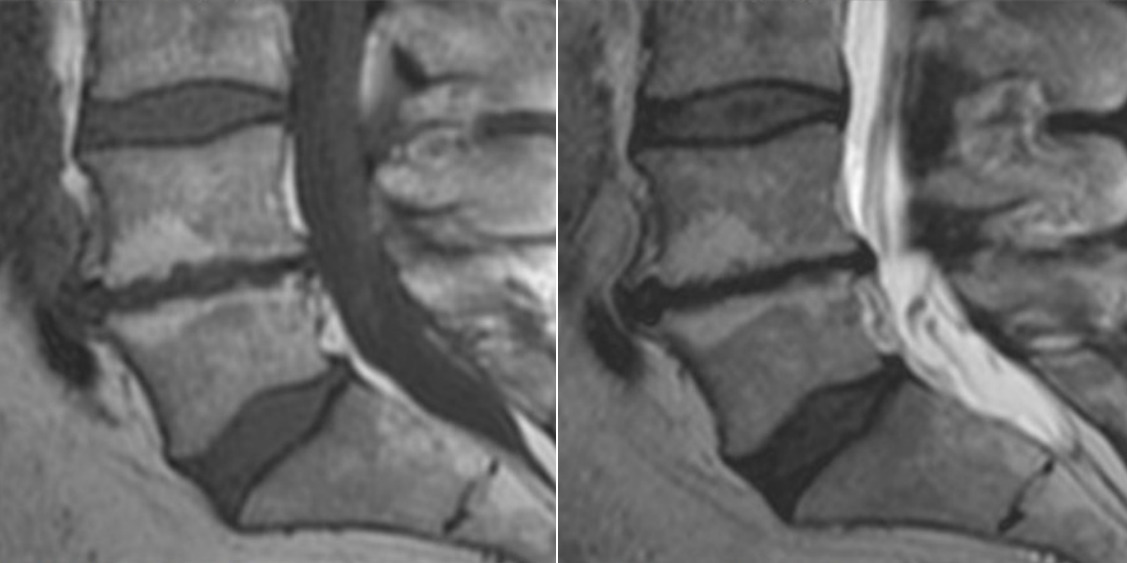
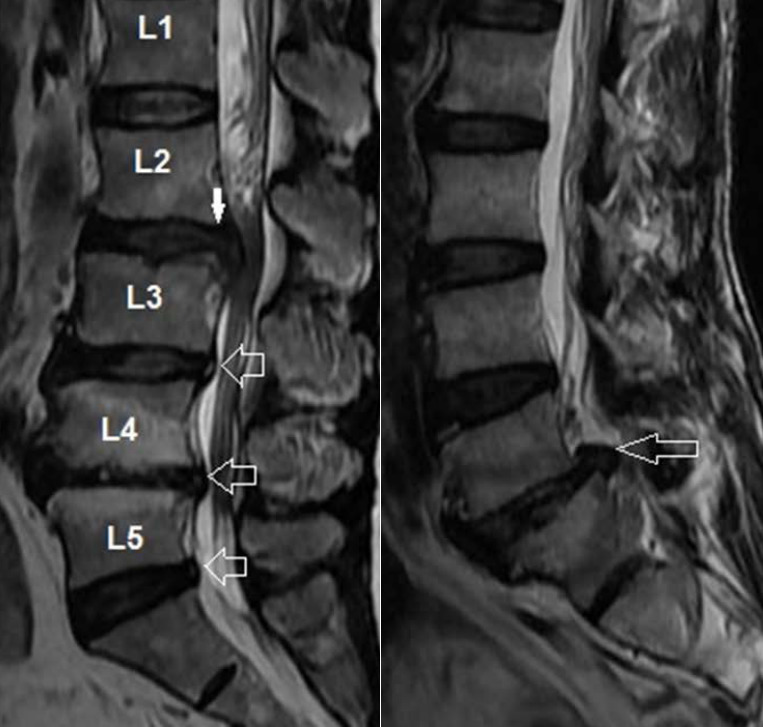
Да, нельзя любую боль в спине называть «остеохондрозом». Это или признаки некомпетентности, или шарлатанства. Отсюда походное: ушла боль — вылечил «остеохондроз». Это так не работает. Это 100% шарлатанство и подмена понятий.
Межпозвонковый остеохондроз имеет свои отличительные рентгенологические признаки: выраженное снижение высоты диска, наличие узураций замыкательной пластинки, наличие реактивных изменений тел позвонков по Модику 1/2 типа, наличие горизонтально направленных остеофитов и гипермобильность/нестабильность в сегменте.
Рентгенологически межпозвонковый остеохондроз в острой фазе — это изменения по Модику 1 (асептическое воспаление диска и прилежащих тел позвонков), хронический остеохондроз — рентгенологически — это Модик 2 (жировое замещение костного мозга).
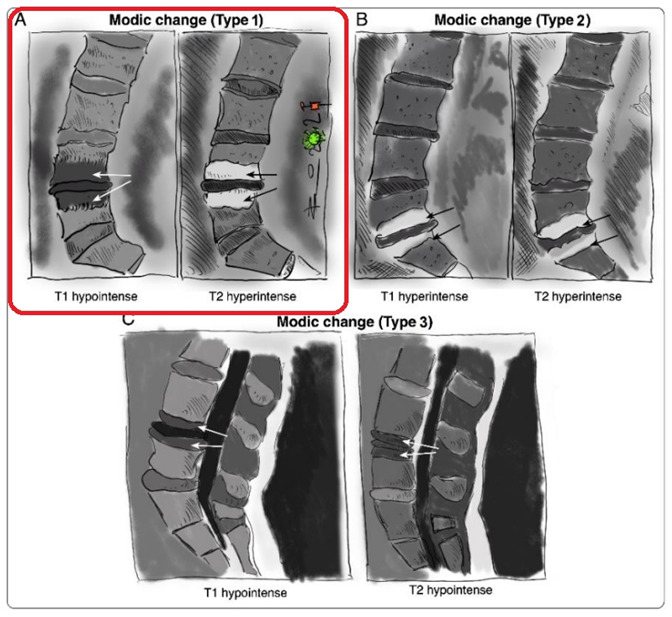
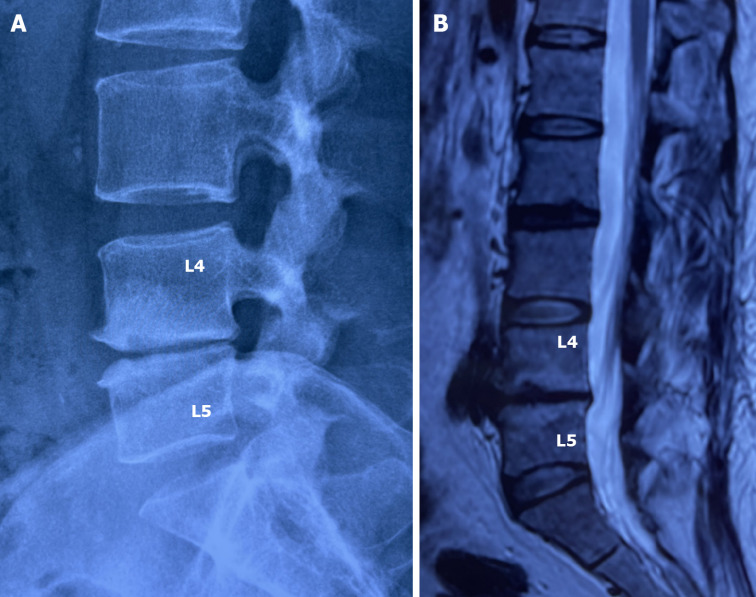
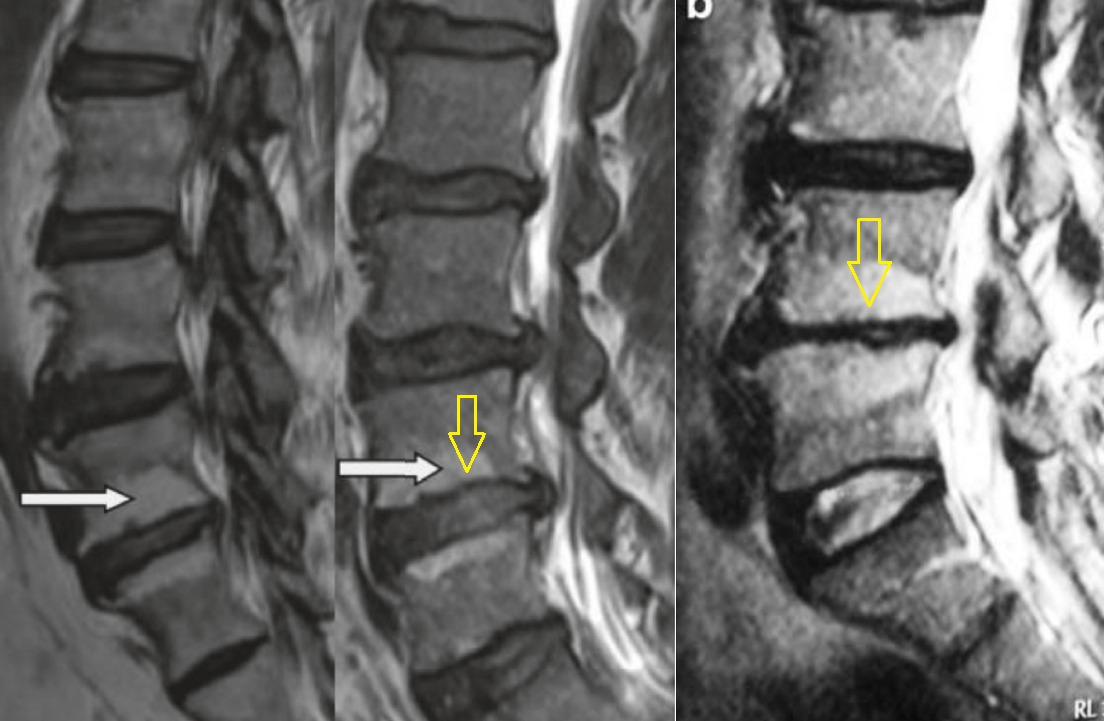
В исследовании Тойоне (Rahme & Moussa, 2008.) у 70% пациентов с изменениями по Модику 1-го типа и только у 16% пациентов с изменениями 2-го типа была обнаружена сегментарная гипермобильность, определяемая как сагиттальное смещение на 3 мм и более на функциональных рентгенограммах при сгибании — разгибании. Авторы пришли к выводу, что у пациентов с хронической болью в пояснице с изменениями по Модику 1-го типа чаще наблюдалась нестабильность, требующая артродеза, чем у пациентов с изменениями 2-го типа.
Рентгенологи Тагер И. Л. и Мазо И. С. уже в 1979 году предупреждали врачей, что: «Различные виды смещений позвонков встречаются значительно чаще, чем это определяется при рентгенографии позвоночника в стандартных проекциях и именно в результате смещений возникает болевой синдром. Поэтому главной задачей врача является стремление к раннему выявлению смещений позвонков, когда можно успешно применить рациональное лечение и с помощью правильного трудоустройства стабилизировать наступившие, но еще небольшие смещения позвонков».
Если диск дегенерировал, но он никак себя клинически не проявляет, то данный тип изменений классифицируют как «спондилез» — возрастная дегенерация. Благополучным финалом разрешения остеохондроза будет стабилизация сегмента фиброзно-мышечным блоком и склеротические изменения тел позвонков по типу Модик 3, что в рентгенологическом диагнозе будет отмечено как «спондилез» (тип течения 2 по Шмидт).
При дегенеративном заболевании диска объем вырабатываемых провоспалительных цитокинов в среднем может в 2—8 раз превышать содержание их в тканях нормально стареющего диска. Лабораторно фиксируется повышенный уровень фактора некроза опухоли– α (TNF-α) — показатели могут превышать норму в 25 раз; показатели высокочувствительного С-реактивного белка — в 30 раз и более. (Khan A. N., 2017).
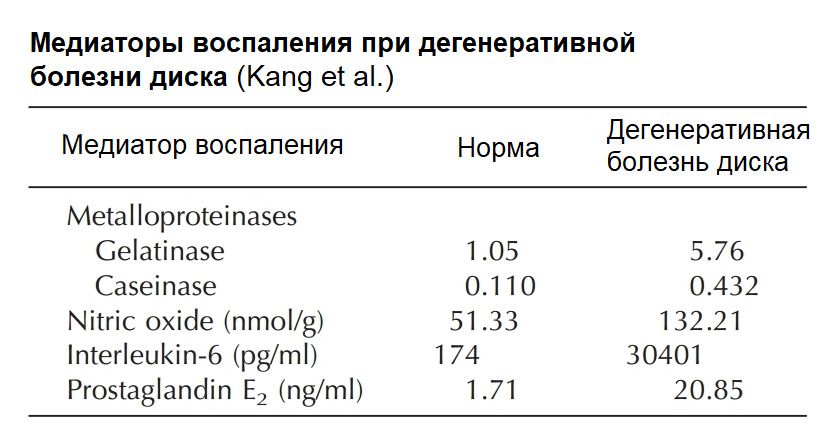
При остеохондрозе пульпозный комплекс диска выгорает за год-два и от него может практически ничего не остаться. Дегенерирующий диск может терять по 3% высоты в год и быть источником боли до 8 лет. При этом сила боли и снижение/нарушение трудоспособности или последующая инвалидизация не связаны со степенью дегенерации диска: критически дегенерированные диски вообще могут быть безболезненны, при этом диски с едва заметной дегенерацией могут давать мучительные боли.
При генетической предрасположенности к заболеванию и суммы неблагоприятных факторов процесс протекает быстро и агрессивно: цитокины индуцируют избыточный и неконтролируемый синтез матриксных металлопротеиназ и аггреканаз, что приводит к химическому расплавлению и выгоранию пульпозного комплекса в кратчайшие сроки.
Ключевым фактором «расплавления» и разрушения диска является синтез типов металлопротеиназ 1,3 и 13, хотя клетки диска синтезируют также 2, 9 и 4 типы.
Матриксные металлопротеиназы (ММР) — это ферменты, которые расщепляют аминокислотные связи в белках, по сути — фрагментируя их. Металлопротеиназы играют центральную роль в обмене белков соединительной ткани, участвуют в процессах ремоделирования клеточного матрикса, репарации ткани, неоангиогенезе, эмбриогенезе и развитии тканей. В норме металлопротеиназы 1,2,3,9 выполняют функцию конвертаз: после их активации они разрушают и деактивируют цитокин IL-1β, который их активировал (обратная связь) с одновременным высвобождением факторов роста (например, Трансформирующего фактора роста — бета 1), которые находились в матриксе в неактивной («связанной») форме. Так называемое, гомеостатическое ремоделирование ткани.
ММР-1 (коллагеназа позвоночника) — ключевая протеиназа регрессии тканей у человека.
ММР-2 (желатиназа А) — участвует в деградации коллагена IV типа — главного компонента базальных мембран. Повышен уровень при остеоартрите.
ММР-3 (стромелизин 1) — протеиназа-«детонатор»: активирует 1,7,8 и 13 типы, что приводит к быстрому разрушению хрящей.
ММР-9 (желатиназа В) — вместе с ММР-2 разрушает мембраны клеток, связана с хроническими аутоиммунными заболеваниями и фиброзом тканей.
ММР-13 (коллагеназа 3) — активируется оксидом азота (NO), вовлечена в развитие артритов и ревматоидного артрита, связана с незаживаемостью ран.
ММР-14 — активатор ММР-2; разрушает внеклеточный матрикс, стимулирует продукцию ангиогенных факторов с одновременным подавлением анти-ангиогенных факторов, таким образом влияя на «созревание» эндотелиальных клеток и ангиогенез сосудов.
При этом нарушение синтеза ММР-7 приводит к избыточному накоплению остеопонтина в пульпозном комплексе, что ведет к кальцификации диска, с одновременным снижением синтеза остеопонтина в замыкательной пластинке. Патологически «минерализованный» диск хуже распределяет компрессионную нагрузку и более подвержен растрескиванию и разрушению.
Интерлекин — 1β и TNF-α активируют синтазу оксида азота (NOS), который окончательно подавляет действие тканевых ингибиторов матриксных металлопротеиназ и аггреканаз (TIMP). Уничтожение аггрекана и матрикса предрешено.
Проблема заключается в том, что клетки аутокринно (действие на себя) подстегивают выработку провоспалительных цитокинов своими же цитокинами, которые связываются с рецепторами мембран своих же клеток. Происходит самостимуляция синтеза. Синтез и выброс идет лавинообразно: выработка цитокинов усиливает выработку цитокинов:
Избыточный выброс фактора некроза опухоли-α (TNF-α) с последующей активацией «рецепторов смерти» запускает сигнальные пути внутриклеточных каспаз, что, в лучшем случае, — приводит к апоптозу (активируя Wnt), в худшем — к пироптозу (активируя сигналинг MAPK и NF-κB). По сути — это химическое «самоубийство» клетки. Аутокринное самоотравление продуктами своей секреции.
В любом случае, фенотипически «старые», «самоубийцы» и погибшие «насильственной смертью» клетки являются постоянным источником провоспалительных цитокинов или запускают воспаление в диске. Хочу сразу оговориться, что на ранних этапах дегенеративные процессы в пульпозном комплексе протекают безболезненно. Это расплавление/разрушение матрикса и фрагментация пульпозного ядра на глыбки/фрагменты. Боль возникнет тогда, когда появится контакт дегенерирующего материала пульпозного комплекса со свободными нервными окончаниями на периферии фиброзного кольца. По факту это будет означать просачивание жидкой фракции или смещение фрагментов на периферию диска через образованные дефекты во внутренних ламелях фиброзного кольца. До грыжи рукой подать.
Дегенерация диска вследствие физической перегрузки. «Механическая» дегенерация диска
Здесь все намного проще. Первое. Избыточная физическая нагрузка, чаще всего компрессионного характера, вызывает физическую деформацию мембран клеток и активацию главных механочувствительных каналов PIEZO1. Это приводит к резкому и избыточному входу кальция в клетку. В клетке в норме кальций хранится только в эндоплазматическом ретикулуме (цех сборки белков) и митохондриях (энергетических станциях клетки) и расходуется только для обеспечения метаболических процессов. Количество цитозольного кальция под строгим контролем. По мере надобности специализированные «насосы» закачивают/откачивают кальций из цитоплазмы/в цитоплазму, предотвращая запуск неконтролируемых каскадов. Избыточная компрессия клеток приводит к «соединению» эндоплазматического ретикулума и митохондрий через кальциевый рецепторный «тоннель», при котором происходит резкая перекачка кальция их ретикулума в митохондрии. Гиперстимуляция приводит к перегрузке митохондрий, повреждению внутренней и наружной митохондриальных мембран «перфорирующими» белками BAX и BAK с последующей утечкой цитохрома С и апоптических белков, которые активируют каскад внутриклеточных биохимических реакций, запускающих апоптоз или пироптоз.
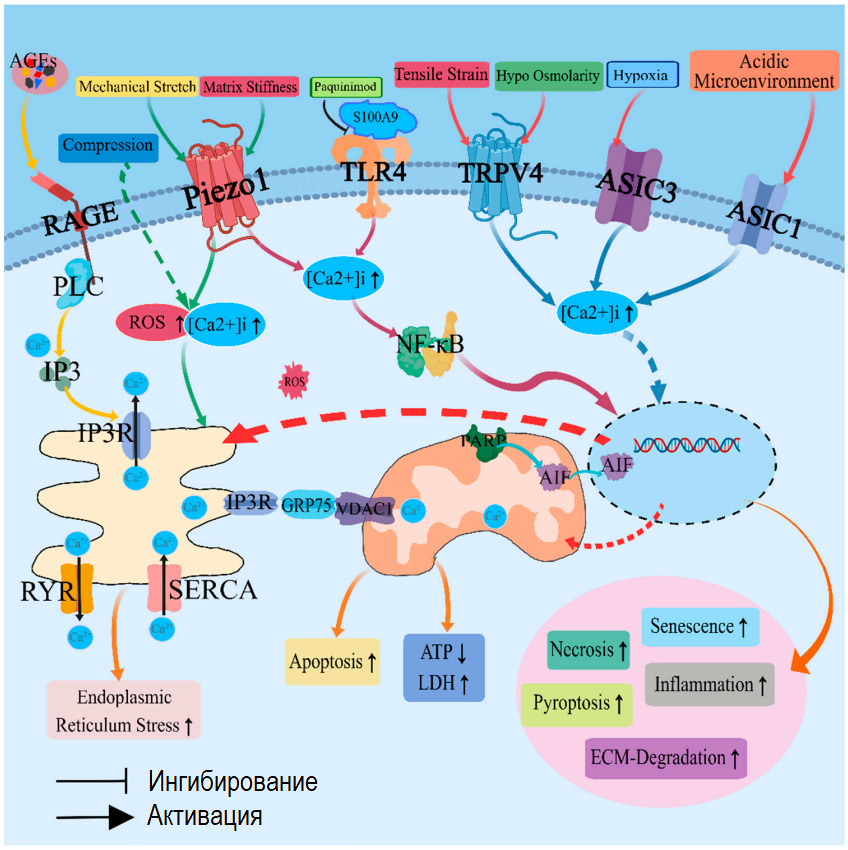
Рецепторы PIEZO специализируются на любых типах механической деформации ткани, поэтому чем более «жесткий» экстраклеточный матрикс пульпозного ядра, тем сильней деформируются клеточные мембраны и легче открываются «поры» PIEZO. И больше входит кальция, что ведет к ускорению смерти клеток и дегенерации диска.
PIEZO1 через стимуляцию сигналинга ядерного фактора-κB (NF-κB) активирует гены, ответственные за синтез периостина, провоспалительного белка внеклеточного матрикса, который по типу обратной связи стимулирует продукцию и секрецию IL-6, IL-8, простагландина Е2 (PGE2) и оксида азота (NO). Периостин — маркер затяжного воспаления и фиброза тканей.
Также рецепторы PIEZO1 индуцируют активацию еще одного механочувствительного ванилоидного рецептора TRPV4 через усиление синтеза фосфолипазы А2-кальций-зависимого фермента (в избытке в дегенерирующем диске), что нарушает его работу. Больше всего механочувствительного рецептора TRPV4 находиться в фибробластах фиброзного кольца, поскольку данный тип рецепторов специализируется на тракционной нагрузке — рабочий анаболический диапазон деформации 3—8%. Все, что свыше — запускает катаболический каскад. Дефектный рецептор TRPV4 обеспечивает постоянный приток кальция (Ca2+) при тракционной нагрузке, что вызывает дисфункцию митохондрий и старение/смерть клеток. Соответственно, избыточная тракция или ротация диска (а это, по сути, и есть тракция волокон), приводит к повреждению волокон фиброзного кольца и формированию в нем трещин.
Патологическая активация механического сигнального пути Rhoa/ROCK1 через цитозольный актино-миозиновый комплекс приводит к остановке пролиферации и апоптозу клеток.
Накопление поврежденных ДНК при регулярном физическом стимуле также ведет к апоптозу.
PIEZO1 не единственный рецептор, реагирующий на механическую нагрузку. Ему также помогают кальциевые рецепторы GPR 35 и 75. Кальций — это основной вторичный мессенджер, участвующий почти во всех внутриклеточных процессах. Хроническая кальциевая «интоксикация» клетки — это всегда оксидативный стресс, нарушение митофагии (устранение поврежденных митохондрий), слом аутофагии (устранение поврежденных органелл и дефектных белков), ускоренное старение и смерть клетки.
Кратковременный оксидативный стресс является «тренирующим» событием для клетки и повышает ее оксидативную выносливость за счет повышения продукции HIF-1α и ядерного фактора эритроидного происхождения-2 (Nrf2). Поврежденные митохондрии лизируются при помощи митофагии — процесса устранения поврежденных митохондрий. За это отвечают «программы» внутриклеточной «очистки», запускаемые и контролируемые коактиватором-1α (PGC-1α).
Если компрессионная нагрузка чрезмерная или умеренная, но достаточно длительная и регулярная, то клетки не успевают проводить «починку» повреждений, вызванных оксидативным или эндоплазматическим стрессом, соответственно, активируют сигнальные пути, запускающие апоптоз.
Сигнальный путь mTOR является контроллером клеточного цикла на разных фазах и основным исполнителем процессов митофагии/аутофагии, но сбои в программах приводят к тому, что лизосомы начинают поглощать и «переваривать» не только дефектные белки и митохондрии, но тащить на утилизацию полноценные белки и органеллы. Таким образом, внутренний «косметический ремонт» может плавно перерасти в «дом под снос» с переходом в апоптоз.
Интоксикация кальцием — основная причина раннего старения и гибели клеток организма.
Более грубая аналогия для понимания «усвояемости» кальция на примере алкоголя: рюмка коньяка — хорошо; две — лучше; три — отлично; бутылка «залпом» — тяжелая интоксикация; литр «залпом» — дорога в реанимацию или на кладбище.
Механизмы запуска пироптоза клеточным «мусором», продуктами гликации и пропионовыми бактериями (Propionibacterium acnes)
На мембранах иммунных клеток находятся различные типы специализированных рецепторов распознавания антигенов. Классические паттерн распознающие рецепторы (Toll-подобные (TLR), NOD-подобные и AIM2-подобные) распознают стандартные молекулярные структуры, специфичные для больших групп патогенов. Активация данных рецепторов запускает воспалительный иммунный ответ по стандартной программе уничтожения патогена.
Вышеперечисленные рецепторы распознают несколько типов сигнала: патогены (внешний — вирусы, бактерии, простейшие и пр.) и собственную поврежденную ткань (внутренний — клеточный «мусор»). Такие же рецепторы, но в меньших количествах присутствуют и на мембранах клеток пульпозного ядра (как часть механизма врожденного иммунитета). Основную проблему клеток межпозвонкового диска составляют рецепторы неклассического универсального типа: RAGE — рецепторы, распознающие продукты гликации (Advanced glycation end products; AGE); G-протеин сцепленные — активируемые банальным избытком кальция или лигандами; ионные рецепторы (транзиторного переходного потенциала; TRP) и пуриновые (Р2Х) — активируемые АТФ и активными формами кислорода (АФК). Как раз именно теми медиаторами воспаления, которые в избытке присутствуют в дегенерирующем диске. Данные рецепторы, по сути, вспомогательные, но значимо усиливающие действие основных паттерн распознающих рецепторов.
Неспецифические и специфические рецепторы вместе с адаптерными белками и белками–активаторами (каспазы) формируют инфламмасомы (NLRP1, NLRP3 и NLRC4). В пульпозном комплексе инфламмасомы в клетках активируется детритом (продуктами распада клеток/матрикса), продуктами гликации и пероксидами. Активация инфламмасомы NLRP3 приводит к пироптозу, а клетки, погибшие пироптозом, в свою очередь сами становятся источником клеточного «мусора», запуская цепную реакцию.
Одним из факторов быстрого прогрессирования заболевания диска является объем накопленного клеточного «мусора» в межклеточном матриксе. Это так называемая дегенерация диска вследствие износа («wear and tear») — выполнения однотипных движений (даже низкой интенсивности), но длительный срок. Это гибель клеток по причине отсутствия отдыха и неспособности вовремя восстановить гомеостаз пульпозного комплекса. К клеточному «мусору» будут относиться различные фрагменты белков матрикса (фрагменты гиалуроновой кислоты, гепаран сульфат, фибронектин, окисленные молекулы, липопротеины и др.), которые распознаются Toll-подобными рецепторами (TLR) 2 и 4 типа. Но основную опасность представляют ядерные белки. «Разорванная» клетка является источником большого количества активных белков типа алармина S100A8/9, белков теплового шока (HSP), «ядерного» амфотерина (HMGB1; High-mobility group box) и др.
Внутриядерно белки амфотерины (HMGB1) работают как помощники транскрипции, внеклеточно функционируют как алармины, которые представляют собой эндогенные молекулы, высвобождаемые при повреждении тканей для активации клеток иммунной системы. HMGB1 действует как медиатор воспаления и способствует длительному и устойчивому системному воспалению.
Клетки мгновенно отреагируют на подобный химический сигнал попыткой быстро очистить внеклеточный матрикс.
Любая очистка — это контролируемое воспаление с дальнейшим восполнением клеточного состава и ремоделированием матрикса. При остеохондрозе (агрессивно протекающей дегенерации диска) обширное воспаление усиливается избыточным синтезом матриксной металлопротеиназы 3 типа (ММР-3) (генетическая наследственность), которая индуцирует синтез ММР-1 и 13 типа. Из всех металлопротеиназ ММР-13 — самая свирепая по отношению к коллагену II типа — ее сила разрушения превышает «конкурентов» в 5—10 раз. Поэтому пульпозный комплекс очень быстро «выгорает» и диск теряет тургор. Сегмент становиться гипермобильным или даже нестабильным, разрушая под нагрузкой остатки пульпозного комплекса и ламели фиброзного кольца, каскадно увеличивая вброс «мусора».
Еще один механизм дегенерации связан с хроническим низкогредиентным воспалением, вызванным накоплением продуктов гликации (AGE), — неразрушаемых комплексов матриксных белков, соединенных с неутилизированной глюкозой. Дегенерированный диск по цвету напоминает жженый сахар. Также при данном типе поражения наблюдается выраженная кальцификация замыкательных пластин.
Избыток глюкозы также вреден для клеток диска, как и ее недостаток. Высокое напряжение кислорода и избыток глюкозы — причина оксидативного стресса.
Сам по себе гликированный мусор является сигналом к воспалению через активацию рецепторов для AGE (RAGE) и NOD-подобных рецепторов. Накопление продуктов гликации связано с низким анаболическим профилем клеток пульпозного ядра (вследствие гиподинамии, например) и повышенным содержанием глюкозы в крови (сахарный диабет). Поступление питательных веществ в диск (глюкоза) — это хорошо, но ее еще нужно клеткам утилизировать. Избыток глюкозы в клетке сам по себе может активировать инфламмасому. Накопление продуктов гликации вызывает стресс эндоплазматического ретикулума через нарушение регуляции кальция Са2+. Эндоплазматический стресс — причина пироптоза.
AIM2-подобные рецепторы (absent in melanoma — like) среагируют на фрагменты ломаного ДНК или бактерии, вирусы. А ДНК ломают как активные формы кислорода, так и гликированные молекулы.
Фагоцитирующие клетки пульпозного ядра (аналог тканевых макрофагов) на своей мембране имеют малое количество Toll-, NOD-подобных, AIM2-подобных и RAGE рецепторов, а вот «пришлые» макрофаги, мобильные клетки врожденного иммунитета, которые со временем проникают в дегенерированный диск, — эти имеют всю номенклатуру PRR рецепторов плюс специфичные и неклассические. Иммунная система весь клеточный «мусор» распознает как патоген и пытается от него избавиться через воспалительную реакцию. Причем воспалительный потенциал макрофагов в десятки раз превосходит воспалительный потенциал внутридисковых «дилетантов». Продукты гликации могут выступать как стимул для развития низкогредиентного системного воспаления во многих органах и быть причиной хронических заболеваний. Вероятно, половина всех существующих болячек у современного «западного» человека связана именно с хроническим перееданием и накоплением в организме продуктов гликации.
Идем дальше.
Схлопывание матрикса и проседание диска приводит к переносу компрессионной нагрузки на фиброзное кольцо и увеличение линейного сдвига тел позвонков относительно друг друга при сгибаниях/разгибаниях/ротации, что приводит к еще более выраженному усилению катаболических процессов в диске за счет изменения трансдукции — преобразования механического сигнала в необходимый клеточный ответ. В гипермобильных и нестабильных сегментах в дисках всегда преобладают катаболические процессы, даже если диск изначально здоров. Не работает система актин-миозиновых «вожжей» через нарушение/блокирование работы интегринов. Ранняя дегенерация пульпозного ядра всегда сопровождается его фрагментацией и формированием обособленных «глыбок». Клетки пульпозного ядра межпозвонкового диска у людей без генетической предрасположенности к дегенеративному заболеванию в ответ на катаболические стимулы ответят усиленной выработкой коллагена первого (I) типа и разрастанием остеофитов по периметру диска, что приводит к саногенетической самостабилизации пораженного сегмента. В дисках могут образовываться трещины, полости, между фиброзным кольцом и пульпозным ядром полностью стираются границы, но такой диск практически не теряет высоты. Максимум 30%. Он просто превращается в единый фиброзно-хрящевый конгломерат. Плотную инертную фиброзно-хрящевую «прокладку». Сам же позвоночно-двигательный сегмент становится более тугоподвижным, что является возрастной нормой. Иногда до фиброзного анкилоза. Данный тип дегенеративного поражения диска рентгенологами будет обозначен как спондилез. Чаще всего данный вид дегенерации не сопровождается симптомами, если нет критического сужения позвоночного канала, приводящего к нарушению кровообращения спинного мозга и корешков. Подобная дегенерация рассматривается как естественный физиологический процесс старения диска. При спондилезе организм успевает приспособиться к выключению «стареющего» ПДС из кинематической цепи, отрегулировать и согласовать мышечные рефлексы глубоких сегментарных и поверхностных мышц, адаптировать регионарное кровообращение с учетом стенозирующих процессов в позвоночном канале, т.е. провести все саногенетические «мероприятия», направленные на восстановление функций позвоночника.
И если естественный процесс старения диска и его ремоделирование происходит медленно и постепенно, то патологический процесс имеет «взрывной» характер и зачастую протекает лавинообразно.
При дегенеративном заболевании диска (остеохондрозе) выраженная внутренняя воспалительная реакция, постоянно подстегиваемая быстро накапливающимися продуктами распада, может в кратчайшие сроки разрушить не только сам пульпозный комплекс, но и значительно повредить ламели фиброзного кольца в целом. Это связано с резкой декомпрессией гелевого комплекса и быстрым переносом компрессионной нагрузки на наружные слои фиброзного кольца, что приводит к образованию крупных щелей и трещин, через которые возможен выброс элементов пульпозного комплекса, содержащих большое количество провоспалительных цитокинов и хемокинов за пределы наружного кольца. Через эти структурные дефекты происходит инфильтрация (проникновение) вглубь диска клеток иммунной системы: нейтрофилов, моноцитов, макрофагов и клеток-натуральных киллеров, чего в норме никогда не бывает. Клетки иммунной системы внутри диска — это всегда к ускорению и усугублению дегенерации.
При наличии незначительных трещин при компрессионной нагрузке с элементами ротации может происходить просачивание «жидкой» фракции гелевого комплекса к периферии диска или за его пределы, что может вызвать воспаление в наружной части фиброзного кольца или жировой клетчатке позвоночного канала. На МРТ изображениях — так называемые Зоны высокоинтенсивного сигнала (High intensity zone; HIZ).
Во многом скорость и агрессивность дегенерации диска определяется именно участием клеток иммунной системы в процессе уничтожения пульпозного комплекса.
Данная фаза дегенерации диска получила название Макрофагозависимая: речь идет о профессиональных «чистильщиках» организма, которые отличаются нулевой толерантностью к патогенам (речь идет об иммунной системе людей молодого и среднего возраста; у пожилых — наоборот: иммунка вялая, отсюда и все старческие болячки).
В старых клетках пульпозного ядра под воздействием провоспалительных цитокинов увеличивается синтез хемокинов, «приманивающих» клетки иммунной системы в очаг поражения: моноцитарного хемоаттрактантного белка-1 (MCP-1), макрофаговых воспалительных белков (Macrophage inflammatory protein MIP1a/CCL3, и MIP1b/CCL4), хемокин регулируемых и нормальных Т-клеток (regulated and normal T cell expressed and secreted RANTES/CCL5), хемокина для моноцитов и Т-лимфоцитов (MCP-4/CCL13), хемокин Т-лимфоцитов (MIP3a/CCL20), протеина активации нейтрофилов (neutrophile activating protein — 3 (NAP) /CXCL1), хемокина «хронической боли» и роста сосудов интерлейкина-8 (IL-8/CXCL8), монокина для активированных Т-лимфоцитов (monokine induced by gamma interferon (MIG) /CXCL9), белка, индуцируемого интерфероном гамма-10 (interferon gamma induced protein-10 (IP) /CXCL10; хемокин для всех типов иммунных клеток, маркер тяжелого течения заболеваний).
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.