
Бесплатный фрагмент - Теоретические и экспериментальные аспекты обратного переливания крови
Предисловие
На рубеже ХХ-ХХI веков началось лавинообразное развитие всей совокупности наук о жизни, начался процесс переосмысления на основе новых данных накопленных медициной фактов предрасположенности человека к различным заболеваниям, механизмов его иммунной защиты, а также роли окружающей среды и стрессов в развитии болезней — всего, что определяет здоровье человека, его долголетие и качество жизни. Появилась синергетическая наука — биомедицина. Биомедицина — это симбиоз медицины и биологии, в основе которого лежит использование для решения медицинских проблем идей и технологий, разработанных в биохимии, иммунологии, клеточной биологии и других биологических науках.
Наиболее важные направления биомедицина — это: ранняя диагностика заболеваний, в т.ч. выявление наследственной предрасположенности к «обычным» болезням; определение индивидуальных генетически обусловленных особенностей реакций организма на лекарственные вещества (фармакогеномика); разработка методов лечения наследственных болезней; методы диагностики инфекционных и неинфекционных заболеваний (в частности, с помощью т.н. биочипов); многократное ускорение разработки новых лекарственных средств за счет компьютерного моделирования, автоматизированного скрининга потенциальных препаратов, применения в преклинических испытаниях кандидатных веществ клеточных культур вместо лабораторных животных; создание принципиально новых лекарственных препаратов на основе антител, генотерапии, в т.ч. с помощью коротких интерферирующих РНК, и других достижений в области молекулярной биологии и нанотехнологий; применение методов генной инженерии, в частности, для получения человеческих белков с помощью трансгенных микроорганизмов, растений и животных; клеточная терапия, тканевая инженерия и разработка методов выращивания органов для трансплантации.
Считаем наужным перечислить соответстующие определения биомедицины. Биомедицина — это комплексная, интегративная, медико-биологическая, междисциплинарная отрасль знания, в основе которого лежит использование для решения медицинских проблем идей и технологий, разработанных в клеточной биологии, биохимии, биофизики, патофизиологии, патоморфологии, иммунологии, и других биологических науках. Биомедицина — это отрасль науки, изучающая жизнь человека и качество этой жизни, основанном на переосмыслении новых научно-медицинских данных предрасположенности человека к различным заболеваниям, механизмов его функционально-физиологической, иммунной защиты, а также роли окружающей среды и стрессов в развитии болезней. Биомедицина — это основа развития ранней диагностики заболеваний, основанной на прогнозировании предрасположенности к человека к болезням; на определении индивидуальных генетически обусловленных особенностей реакций организма. Биомедицина — это основа разработки эффективных методов лечения болезней, основанных на многократном ускорении разработки новых лекарственных средств за счет компьютерного моделирования, автоматизированного скрининга потенциальных препаратов, применения в преклинических испытаниях кандидатных веществ клеточных культур. Биомедицина — это основа для создания принципиально новых лекарственных препаратов на основе антител, методов клеточной и тканевая инженерии, а также разработка методов выращивания органов для трансплантации.
Итак, безусловно, биомедицина — одна из кардинальных направлений современной биологии и медицины в симбиозе. Когда мы говорим о возможностях, которые предоставляют медицине новые направления науки, надо всегда ставить вопрос: готовы ли медики, в особенности хирурги, к тому, чтобы использовать достижения биологических наук в своей деятельности? Как известно, хирурги всегда отличались консервативностью взглядов. Возможно, это оправдано, так как предметом деятельности хирургов является человек и его жизнь. Суть консерватизма хирургов состоит прежде всего в укоренившейся привычке, твердо закрепленной в десятках поколений врачевателей и ученых, делить и строить науки, руководствуясь функциональным, а не субстратным принципом, придерживаясь и проповедывая тем самым принцип сепаратизма своей науки. А ведь во дворе XXI век, который диктует синергетичность наук. В этом аспекте, современная хирургия все чаще представлет собой биоинженерную специальность, так что, сейчас, в настоящее время «хирургия слишком серьезная специальность, чтобы ею занимались только хирурги».
ВВЕДЕНИЕ
Итак, надо понять одну непреложную истину: дальнейшая дифференциация науки в современных условиях приводит не к их разобщению, как это было раньше, а, напротив, к их интеграции. Речь идет о прогнозировании и реальном формировании единой науки будущего. Каким образом будет формироваться наука будущего? Каковы ее реальные черты? Прежде всего интеграция будет осуществляться посредством: «цементации» смежных наук, суть которой заключается в «наведении мостов» между разобщенными науками; «фундаментации» наук, сутью которой является проникновение в сферу конкретной науки методов фундаментальных наук; «стержнезации» науки, сутью которой является процесс пронизывания частных наук более общими, абстрактными науками, которые отражают какую-то общую сторону [И.А.Ашимов, 1995]. Допускаем, вероятность того, что феномен «цементации» и «фундаментации» медицины происходит через методику многоуровневого, интердисциплинарного познания (патоморфология, патофизиология, патобиохимия и т.д.). Полагаем, что в современных условиях, когда хирургия представляет собой не просто практическую сферу деятельности, а глубоко эшалонированную биоинженерную специальность, хирургия представляется слишком серьезной специальностью, чтобы доверить ее сугубо хирургам.
В ПЛКиЭХ выполнены ряд научных изысканий в рамках биомедицинской тематики. В данную книгу включены результаты совместных с Буланбековым А. Т. исследований (Часть I.). Речь идет о выяснении механизмов нарушения химизма крови. Нельзя игнорировать, что кровь, излившаяся в грудную или брюшную полость, контактирует с серозными оболочками и различными тканями, что не может, не отразится на физико-химическом ее состоянии, что принципиально важно учитывать при проведении реинфузии крови (РИК). Именно по этой причине, до сих пор, РИК трудно отнести к числу хорошо разработанных и патофизиологически обоснованных методов. В особенности, если речь идет о массивных и поздних РИК. Общими недостатками любой депонированной крови (донорской, аутокрови и пр.) являются повреждения форменных элементов, повышенное содержание свободного гемоглобина (Hb), опасность ее бактериального заражения, трудность собирания без сгустков, большое содержание фибриногена и тромбоцитов, высокая тромбопластическая и фибринолитическая активность, что, безусловно, отражается на состоянии больных, которым эта кровь возвращается. Между тем, до настоящего времени неизученным остается вопрос о динамике морфологии, биохимии и коагулографии крови, излившейся в брюшную и плевральную полости в зависимости от сроков развития, соответственно, гемоперитонеума и гемоторакса. Мы попытались изучить в сравнительном аспекте динамику нарушения морфологического состава, физколлоидного состояния, биохимии и коагулографии крови, излившейся в брюшную и плевральную полости, в зависимости от сроков развития, соответственно, гемоперитонеума и гемоторакса.
Нами выполнена морфологическая, физколлоидная, биохимическая и коагулографическая характеристика крови, излившейся в брюшную и плевральную полости при моделировании, соответственно, гемоперитонеума и гемоторакса у экспериментальных животных. На основании сравнительной характеристики морфологических, физколлоидных, биохимических и гемостазиологических нарушений крови в динамике и в различные сроки выполнена оценка степени пригодности крови, излившейся в брюшную или плевральную полости для РИК.
Полученные результаты позволяют выработать четкую тактику РИК на основе всесторонней характеристики излившейся в серозную полость крови при травме груди или живота. Оценка пригодности крови, излившейся в серозную полость с учетом сроков скопления крови, соответственно, в брюшную или плевральную полости при травме живота и груди позволяет избежать недостатки и осложнения РИК.
В книгу включены результаты совместных с Мусалиевым Б. Ж. исследований (Часть II.). РИК является общепризнанным эффективным и повсеместно доступным способом возмещением острой кровопотери во время оперативного вмешательства у больных с травматическими повреждениями органов грудной и брюшной полости. Важнейшее преимущество РИК перед использованием донорской крови заключается в том, что в сосудистое русло возвращаются собственные форменные элементы и иммунные тела, ферменты, что повышает иммунную реактивность организма, а значит и сопротивляемость организма к инфекции в послеоперационном периоде.
По данным ряда авторов в связи с очень упрощённой обработкой крови (только фильтрацией) возникает ряд осложнений: из-за трансфузии лизированных эритроцитов повышался уровень свободного гемоглобина, первичная активации свёртывания либо фибринолиза вызывала расстройства гемокоагуляции, развивалась даже почечная недостаточность. В целях профилактики таких осложнений в настоящее время используют специальную аппаратуру по эксфузии, фильтрации и РИК. Для сбора крови предложены всевозможные усовершенствованные системы, в том числе и производимые промышленным способом. Между тем, пока эти системы не получили всеобщего признания. Доступные простые методы оказываются малоэффективными, а сложные, аппаратные — эффективными, но малодоступными для широкого использования. В этой связи, надо полагать, что эта проблема заслуживает внимания и дальнейшего совершенствования, главным образом, в направлении доступности.
К разрушению эритроцитов могут приводить многие факторы: особенности техники аспирации излившейся крови; слишком сильное разрежение вакуума; контакт эритроцитов с инородными материалами и воздухом; турбуленция, возникающая в трубках аспиратора и резервуаре; коагуляция; слишком интенсивная эксфузия и пр. В этой связи возникает вопрос: насколько востребованы и безопасны простейшие методы аппаратной эксфузии аутокрови для РИК? Мы решили повысить результативность экстренной коррекции острой кровопотери и гемоциркуляторного шока при повреждениях органов груди и живота на основе совершенствования методических подходов и принципов выполнения аппаратной РИК.
Впервые по материалам НХЦ изучена частота и удельный вес использования РИК, а также выполнена оценка эффективности традиционной технологии РИК у пострадавших с травматическим гемотороксом и гемоперитонеумом. Выполнена сравнительная морфологическая, биохимическая и гемостазиологическая характеристика крови у экспериментальных животных до и после аппаратной РИК при моделировании у них внутриполостного кровотечения. Проведена сравнительная оценка динамики лабораторных показателей до и после РИК при моделировании различных скоростных режимов аппаратной эксфузии крови, излившейся в грудную и брюшную полости.
Полученные результаты позволяют выполнять РИК с учетом не только сроков развития гемоторакса и гемоперитонеума, но и скорости аппаратной эксфузии крови, излившейся в грудную и брюшную полости. Для профилактики осложнений РИК, связанных с повышенным гемолизом и нарушением свертываемости крови, излившейся в грудную и брюшную полости следует использовать медленный режим аппаратной эксфузии крови.
Хотелось бы подчеркнуть, что в настоящее время сама попытка усомниться или даже критически отнестись к возможностям современной биомедицины может быть оценена только отрицательно — как проявление мировоззренческого бессилия, т.е. «пессимизма» по отношению к технологическим перспективам. Существуют два вида такой негативной позиции: первый, «естественный» вид пессимизма выражает скепсис по отношению к биотехнологическим инновациям, но не приводит к требованиям их полного запрета; второй, «неоправданный тип пессимизма» требует полного запрещения работ в этом направлении и представляет собой «выражение идеологического пораженчества». Абсолютное большинство медиков и сейчас склоняются к созерцательно-стоической позиции. Мы же относим себя к стану оптимистов, которые с энтузиазмом воспринимают возможности вмешательств во все механизмы физиологических функций человеческого организма. Биомедицина способствует размыванию прежней, очерченной императивом «не вреди!» границы между «можно» и «нельзя», в переоценке традиционного отношения к возможностям хирургии.
ЧАСТЬ I
ПАТОБИОХИМИЯ, ПАТОБИОФИЗИКА, ПАТОМОРФО-ЛОГИЯ, ПАТОФИЗИОЛОГИЯ АУТОКРОВИ ДЛЯ РЕИНФУЗИИ
Глава 1
Современные проблемы оценки пригодности крови для трансфузии и реинфузии
§1. Проблемы, связанные с переливанием донорской крови в хирургической практике
Анализ литературы показывает, что механизм переливания крови (донорской, аутологичной) должен рассматриваться не столько с точки зрения замещения потерянной крови по принципу «капля за каплю», сколько с точки зрения фармакологического воздействия на те процессы, которые возникают в результате кровотечения [1,5,92,104]. Исходным постулатом является то, что переливаемая кровь — это трансплантат, сохраняющий все свои биофизико-химические свойства: форменные элементы, белки, солевой состав, витамины и т.д., которые оказывают как непосредственное, так и более длительное воздействие [18,33,67,107].
При ранениях груди и живота внутриполостная кровопотеря остаётся одним из наиболее частых и грозных осложнений на практике неотложной хирургии. В связи с этим адекватное восполнение кровопотери у этой категории хирургических больных имеет большое значение [16,27,112]. В определённой степени эта проблема представлялась решённой в связи с широкой организацией банков донорской крови за рубежом и станций переливания крови в нашей стране [23,39,114]. Однако широкое применение донорской крови выявило ряд серьёзных недостатков, связанных с её применением. Среди них, конечно же, экономические затруднения, связанные как с исследованием крови на вышеназванные инфекции, так и с организацией службы крови, и вообще обеспечением препаратами крови, особенно в ургентной хирургии [13,65].
Вышеуказанные проблемы при трансплантации гомологической крови заставляют искать новые подходы в коррекции кислородно-транспортной функции крови [28,36,124]. Каковы основные мотивы для пересмотра классических показаний к гемотрансфузии? Во-первых и прежде всего, применение гемостатических препаратов, обеспечивающих снижение интра- и послеоперационную кровопотерю (апротинин, десмопрессин, трансксаминовая кислота и др.) [4,25,52,95,132]. Во-вторых, использование искусственных заменителей крови [39,46,135]. В-третьих, использование аутокрови пациента [49,51,54,68,142].
Если говорить о недостатках донорской крови, то следует указать на два основных фактора определяющие неполное соответствие донорской крови собственной крови больного: во-первых, чужеродность ее белковой структуры неизбежно вызывает иммунологические реакции с многочисленными, большей частью скрытыми последствиями для организма реципиента [70,82,152]; во-вторых, консервация цельной крови или эритроцитарной массы приводит к множественным изменениям их свойств негативного характера. По этим причинам консервированная донорская кровь в принципе не способна выполнять свои функции с той же эффективностью, которую можно ожидать от собственной крови пациента [9,14,22,116]. Поэтому при массивных кровозамещениях сохраняется высокий риск возникновения системной гипоксии, снижения тканевой перфузии за счёт блокады микроциркуляции и ацидоза [21,35,171].
В таблице 1.1. представлен далеко не полный перечень осложнений, возникающих после аллогемотрансфузий [39]. К вышеперечисленным проблемам трансфузии гомологичной крови следует добавить существование пациентов с редкими группами крови (hr-фактор) [15] и пациентов, религиозные убеждения которых не позволяют переливать им донорскую кровь (Свидетели Иеговы) [40,103,166]. Кроме того, качество самой донорской крови часто вызывает сомнения в ее использовании [39,56,97,114]. Известны данные об изменениях, происходящих в донорской крови при ее хранении [71,82,145]. Так, во время хранения Эр теряют до 96% 2,3-дифосфоглицерата, что сопровождается повышением сродства Hb к кислороду и смещением кривой диссоциации оксигемоглобина влево [95,97].
Hb Эр долгих сроков хранения на протяжении 4 часов после гемотрансфузии не способен отдавать кислород тканям, а полностью восстанавливает свои функции только через 24 часа [86,101,123]. Таким образом, при мнимом улучшении газотранспортной функции (по показателям Hb и сатурации артериальной крови), за счет снижения артериовенозной разницы, гемическая гипоксия не будет достаточно скорригирована. Кроме того, общая приживаемость донорских Эр разных сроков хранения тоже различна: наиболее жизнестойкие Эр до 5 суток хранения — из них с кровообращения выключается 22%, при больших сроках — до 50% общего количества [5,15,106].
Таблица 1.1. Осложнения, связанные с переливанием крови
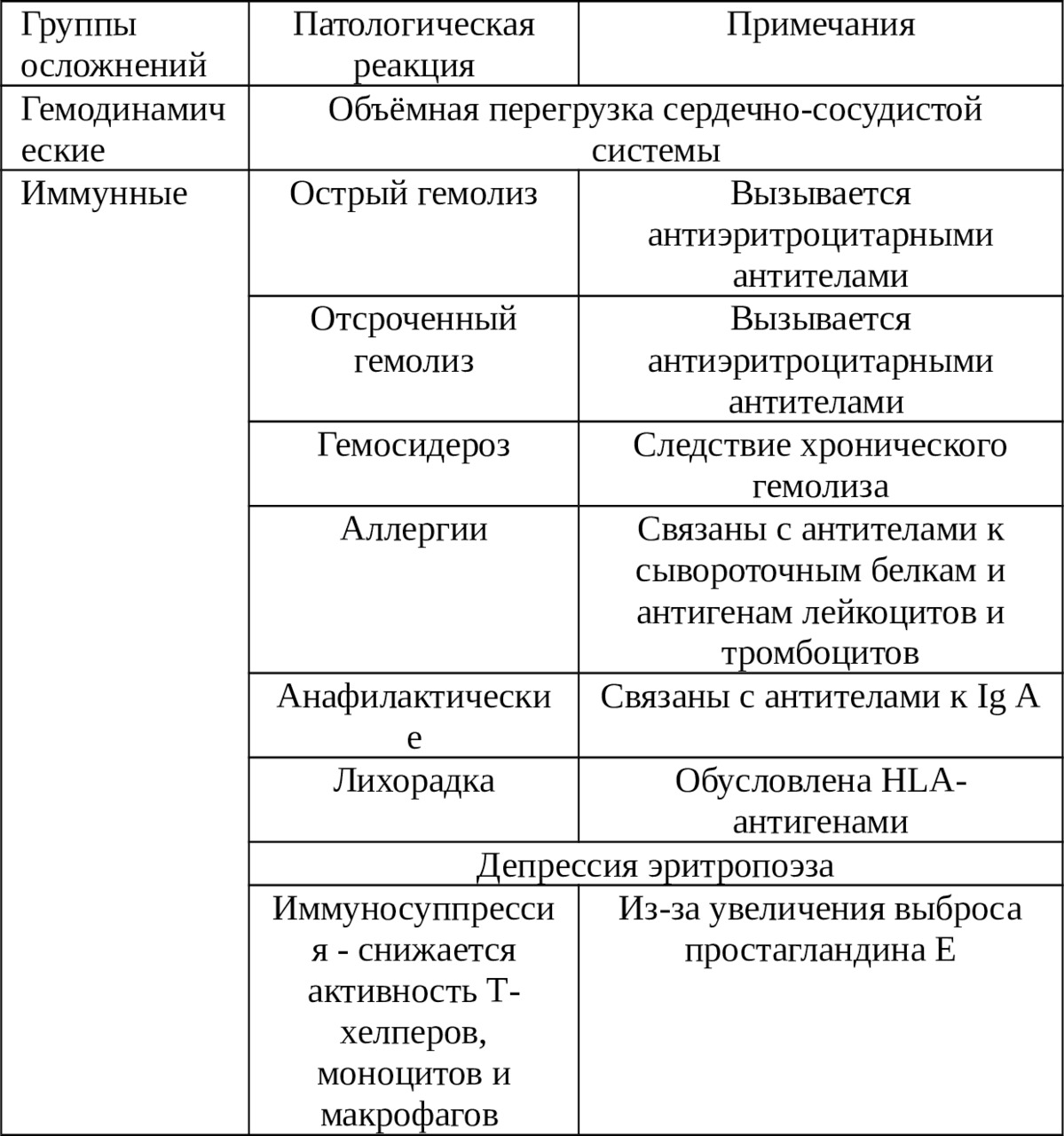
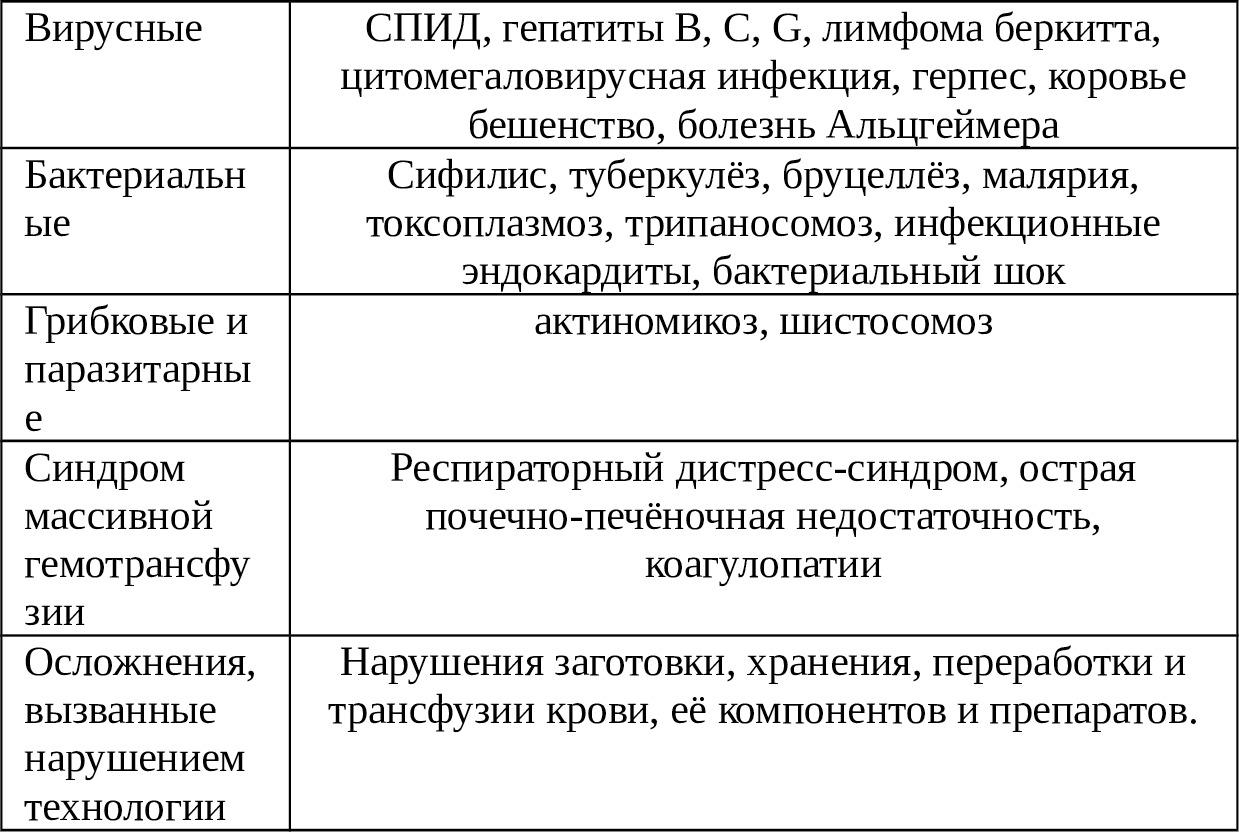
При хранении в донорской крови постепенно снижается кислотность, нарастает калий и количество микросгустков, практически отсутствуют тромбоциты, недостаточное количество факторов свертывания [15,19,26,125].
§2. Проблемы, связанные с обратным переливанием аутокрови в хирургической практике
РИК в экстренной хирургии применяется при разрывах селезенки, печени, почек [2,10,130], при нарушенной внематочной беременности [66,83,96], при операциях на крупных сосудах [16,20,44,100], на органах грудной клетки [23,37] и при целом ряде других хирургических вмешательств с хорошим результатом. С недавних пор используют так называемую дренажную кровь, или кровь, выделяющуюся по дренажам в послеоперационном периоде [82,85,115]. Интраоперационная РИК называется переливание крови пациента, теряемой в ходе операции и текущей кровопотери и реинфузируемой непосредственно во время операции или в ближайшие 6 часов [75,91,99,131].
Концепция РИК крови далеко не нова. После того, как 1818 г. J. Blundell был беспомощным наблюдателем маточного кровотечения, он провел серию экспериментов по РИК на собаках и рекомендовал её для применения у больных [54]. Затем, после долгого перерыва мысль о возвращении крови в сосудистое русло больному, высказал в России в 1865 г. В.В.Сутугин [54].
Следующий период интереса к этому методу начался в 1874 г. с исследования Highmore, который предложил собирать и дефибринизировать кровь, излившуюся после родов, затем согревать её до температуры тела и переливать пациентке при помощи шприца Хиггинсона. В январе 1886 г. John Duncan (Edinburg) первым перелил около 100 мл излившейся крови травматологическому пациенту при операции ампутации нижней конечности. Антикоагулянтом служил цитрат натрия [18,54].
В феврале того же года Miller (Edinburg), провёл неосложнённую РИК больному с экзартикуляцией инфицированного бедренного сустава. Затем, однако, наступил очередной период забвения кровосбережения до тех пор, пока в 1914 году лейпцигский гинеколог Johannes Thies не провёл первую успешную РИК при операции по поводу внематочной беременности, после чего процесс внедрения РИК в рутинную хирургическую практику стал повсеместным [27,54].
Особенно актуальным этот метод стал в период первой мировой войны. Так в 1916 Henry и Elliot стали переливать аутокровь из гемоторакса раненым солдатам [18]. Метод активно применялся и тщательно изучался в России. Так, в 1918 г. А.Н.Филатовым была осуществлена РИК больной с внутрибрюшным кровотечением при внематочной беременности [54].
Доказан факт дефибринирования крови, остро излившейся в серозные полости, и ее пригодность для РИК в первые часы после кровопотери [84]. Уже в 1928 г. А.Н.Филатов доложил о 574 пациентах, которым проводилась РИК, и отметил осложнения, возникшие в результате её. Среди последствий РИК были отмечены озноб, рвота, беспокойство, желтуха и даже несколько смертельных исходов [54]. Причину этих осложнений А.Н.Филатов видел в частности в несовершенстве методов обработки крови.
В США первая РИК была проведена в 1917 году Lockwood’ом во время спленэктомии при синдроме Банти. Всего к 1920 году в мировой медицинской прессе было опубликовано 164 сообщений о применении РИК, а к 1931 их было уже 282 [54]. Так, в частности, в 1931 году Brown и Dagenham применили РИК у гражданских пациентов с гемотораксом [54]. В нейрохирургии первыми применили РИК Davis и Cushing в 1925 году у 23 пациентов, оперированных в госпитале Peter Bent Brigham по поводу опухолей головного мозга [72].
РИК стала широко применяться в общей хирургии, урологии, ортопедии и грудной хирургии. Однако после внедрения в 1935 году техники консервирования донорской крови интерес к РИК резко угас [54]. Лишь единичные упоминания о работах в этой области встречаются в медицинской литературе того времени. Так, в частности, в 1943 г. Arnold Griswold разрабатывает первую систему для РИК, а в 1960 г. Leroy Weeks использует РИК в рутинной практике акушерства и гинекологии [68].
Одним из методов лечения осложнений во время кесарева сечения является интраоперационная РИК [66]. Э. С. Нунаева (1997) на основании результатов лабораторных и клинических исследований представила преимущества и возможности применения интраоперационной РИК аппаратным способом при выполнении кесарева сечения, позволяющей в 99,6% случаев сохранить ультраструктуру и функциональные способности эритроцитов [66].
Определено влияние интраоперационной РИК на клинические, биохимические, гемостазиологические показатели кислородного обеспечения тканей при кесаревом сечении. Полученные результаты продемонстрировали отсутствие коагулянтной активности в реинфузируемой эритроцитной взвеси [66]. Электронно-микроскопические исследования показали, что Эр, использованные для РИК во время операции и полученные способом аппаратной обработки, обладают нормальными структурно-функциональными свойствами, что делает их способными к полноценному функционированию после РИК [9,17,28].
Впервые выявлено уменьшение времени стабилизации гемодинамических показателей крови и улучшение показателей кислотно-щелочного равновесия и газов крови, объемного транспорта кислорода, более быстрое восстановление показателей гемоглобина, количества эритроцитов и объема циркулирующей крови в раннем послеоперационном периоде [38,133,134].
Интраоперационная РИК при кесаревом сечении показана при кровопотере более 700 мл у женщин группы высокого риска развития кровотечений (предлежание и отслойка плаценты, варикозное расширение вен матки, гемангиома органов малого таза и др.), а также при расширении объема оперативного вмешательства (консервативная миомэктомия, надвлагалищная ампутация и экстирпация матки) [66].
Разработана тактика проведения реинфузии крови аппаратным способом во время кесарева сечения [40,66]. В конструкциях аппаратов нового поколения предусмотрен режим высококачественной отмывки Эр большим количеством раствора, делающим процедуру безопасной в акушерстве [84,85].
Проблема ограничения использования донорской крови путем использования аутокрови пациента в настоящее время решается 4 основными путями [4,23,39,60,94]: во-первых, предоперационная заготовка крови пациента; во-вторых, острая нормоволемическая гемодилюция; в-третьих, интраоперационный забор крови из операционной раны с дальнейшей реинфузией; в-четвертых, послеоперационный забор крови из дренажей с ее обработкой и реинфузией.
Интраоперационный забор крови из операционной раны с дальнейшей РИК существует виде обычного и аппаратного варианта [23,88,128]. Данные исследования касаются обычной РИК, так как аппараты для РИК только сравнительно недавно были представлены, а их стоимость не позволяет широко применять метод в условиях обычной клиники [22,23].
Для крови, собираемой во время операции по поводу внутренних кровотечений, характерны минимальные морфологические и биохимические сдвиги. Такая кровь мало, чем отличается от донорской крови трехнедельной консервации [18,32]. Для морфологической картины крови характерно некоторое уменьшение количества Эр и тромбоцитов. Разрушение форменных элементов зависит от гемолитического воздействия серозных оболочек и, главным образом, от механической травмы во время сбора крови [6,17,153,165].
Само по себе разрушение части Эр не обесценивает аутокровь, поскольку оно не превышает 25% их общего количества [13,18,169]. Немедленное же введение этой крови в сосудистое русло позволяет не только улучшить гемодинамику, но и восстановить транспорт кислорода к тканям, снизив тем самым степень развивающейся гипоксии [20,28,63,173]. Повышенное содержание в плазме крови свободного Hb, связанное с разрушением Эр, не превышает предельно допустимых значений и практически не сказывается на функции почек [51,74,166].
Проведенные авторами исследования подтвердили, что повышенное содержание билирубина в моче, клинически проявляется резким изменением цвета мочи на протяжении 2—3 суток после массивных РИК [37,127,170]. Использование в комплексе лечения интенсивного введения кристаллоидов, ощелачивания плазмы крови и сохранение адекватного диуреза поможет избежать скопления и задержку кристаллов Эр в почечных канальцах, что в конечном итоге благотворно сказывается на функции почек [51,59,160].
Лейкоциты аутокрови мало подвергаются разрушению, их количество остается в пределах физиологической нормы, что обеспечивает более высокие бактерицидные свойства реинфузированной крови по сравнению с консервированной [19,39,120]. Аутокровь сохраняет также нормальный электролитный и белковый состав. Изменения сводятся к гиперкалиемии, которая возникает в связи с разрушением форменных элементов крови: калий Эр переходит в плазму [47,52,129].
Для аутокрови характерно либо полное отсутствие фибриногена, либо резкое снижение его уровня, вследствие чего она не свертывается [57,62,144]. Дефибринирование в значительной степени обусловлено ее контактом с серозными оболочками [72,84,151]. Биохимический механизм этого явления заключается в том, что плевра содержит активатор и проактиватор плазминогена, которые обеспечивают образование плазмина и процесс фибринолиза [1,8,35,136]. Образование плазмина и реализация его функции — это физиологические процессы, постоянно происходящие в организме.
Для предупреждения острого фибринолиза и связанной с ним кровоточивости рекомендуют профилактическое внутривенное введение эпсилон-аминокапроновой кислоты [39,44,52,140]. Фибринолитическая активность плазмы повышена в течение первого часа, а затем она снижается, содержание фибриногена повышается [52,69,137].
РИК возможна при кровопотерях, связанных с острым нарушением свертываемости (такая ситуация возникает, как правило, после гистероовариоэктомии, предпринятой по поводу развившихся осложнений) [66,69,143]. РИК, собранной из дренажей после операции позволяет избежать тяжелой анемии, не прибегая к услугам донора [84,94,162]. При этом кровотечение, как правило, останавливается самостоятельно через 2—3 часа. РИК в этих случаях не вызывает дополнительных нарушений гемостаза [89,93,111].
По данным литературы, РИК не приводит к аутоиммунизации, что позволяет в дальнейшем проводить повторные реинфузии, животным уже перенесшим эту манипуляцию ранее [47,61,141]. Каких-либо трансфузиологических реакций на повторные РИК у 53 кошек и 148 собак авторы не наблюдали [47]. При сочетании РИК с переливанием донорской крови, проведенное у 158 животных, патологических реакций также не наблюдалось [61].
Не менее важный вопрос — это стерильность аутокрови. По данным литературы и нашим наблюдениям кровь, излившаяся в серозные полости при повреждениях груди и живота (если нет нарушения целостности полых органов брюшной полости) — стерильна [18,59,86,138]. Это объясняется ее высокими бактерицидными свойствами из-за высокого содержания свежих лейкоцитов. Сказанное выше заставляет хирурга считать асептику операции нарушенной (вскрытие гнойников, попадание в рану содержимого полых органов), исключает возможность РИК [7,8,63,139].
Показаниями для РИК при торакальных травмах являются массивные кровотечения, обусловленные повреждениями сердца, крупных сосудов, легких, а при абдоминальных травмах — ранениями печени, селезенки, сосудов брыжейки кишечника или забрюшинного пространства [55,71,81,154]. РИК противопоказана при гемолизе вследствие длительного пребывания крови в полостях, при сопутствующем повреждении полых органов (желудка, кишечника, желчного и мочевого пузырей) и при выраженных воспалительных процессах, при которых возможно инфицирование крови [3,10,13,18,163].
Достоинства РИК особенно ощутимы при оказании помощи больным с торакальными повреждениями, когда фактор времени играет решающую роль [16,20,158]. Если при абдоминальных травмах необходима ревизия органов брюшной полости, чтобы убедиться в целостности полых органов, то при повреждении груди это условие отпадает [23,34,157].
Производимая многими авторами упрощённая обработка крови (сбор и реинфузия цельной крови) имела множество побочных эффектов: из-за трансфузии лизированных Эр повышался уровень свободного Hb, первичная активация свёртывания либо фибринолиза вызывала расстройства гемокоагуляции, часто РИК осложнялась воздушной эмболией и даже почечной недостаточностью [7,9,48,50,108].
Все авторы отмечают положительный клинический эффект РИК, не исключая возможных осложнений [18,54,61,116]. Важнейшее преимущество РИК перед использованием донорской крови заключается в том, что в сосудистое русло возвращаются собственные форменные элементы и иммунные тела, ферменты, что повышает иммунную реактивность организма, а значит и сопротивляемость организма к инфекции в послеоперационном периоде [42,58,78,122].
В процессе контактирования с воздухом происходит полная оксигенация излившейся крови, ее рН приближается к рН системной крови [86,91,95,127]. Аутотрансфузируемая кровь, в отличие от донорской, не депонируется, а наиболее полно включается в русло циркуляции, эффективнее нормализует кислородно-транспортную функцию крови, для достижения адекватного эффекта ее требуется меньше, чем донорской крови даже малых сроков хранения [58,95,126].
Исследованиями с 51Сr доказано, что реинфузируемые Эр обладают нормальной продолжительностью жизни и не происходит их значительной секвестрации в селезенке [18,79,147]. Анемия бывает менее выражена, а восстановление показателей Hb, Эр, ОЦК происходит быстрее, чем при использовании донорской крови [80,82,149].
Излившаяся кровь незначительно отличается по составу от периферической, циркулирующей в сосудистом русле [18,20,46]. Для крови, собранной из серозных полостей, характерно почти полное отсутствие фибриногена, повышение тромбопластической и фибринолитической активности [43,45,52].
Многие авторы применили технику «отмывания» крови. Основной частью аппарата для РИК — центрифуга [4,23,28,148]. Переливаемая кровь очищалась от лизированных Эр, свободного Hb, антикоагулянтов, активированных факторов свёртывания, внеклеточного калия, миоглобина, частиц кости, жира и клеточного детрита [48,50].
Эти усовершенствования сделали РИК значительно более безопасной процедурой. В 90-х годах была разработана уникальная проточная непрерывная система для РИК с сепарационной камерой, работающей в непрерывном режиме и позволяющей одновременно сепарировать и отмывать красные клетки крови [50,54,155].
Данный процесс гарантирует также эффективное удаление жиров. Постоянный поток крови контролируется в сепарационной камере и это позволяет добиться наивысшего качества красных кровяных телец. Эта уникальная разработка позволяет сепарировать и отмывать красные клетки крови одновременно в одном непрерывном процессе [48,50,159].
Если говорить об абсолютных и относительных противопоказаниях к интраоперационной РИК следует привести следующие сведения. По решению 25 съезда Международного трансфузиологического общества абсолютным противопоказанием к РИК является наличие в излившейся крови: 1) гноя; 2) содержимого толстого кишечника; 3) веществ, противопоказанных к введению в сосудистое русло [18,22,67,172].
Дискуссионным вопросом являются особенности и ограничения РИК у больных с различными заболеваниями крови [54,74,110]. Относительными противопоказаниями для РИК считаются примесь амниотической жидкости, содержимого тонкого кишечника, онкология, когда решение о возможности использования РИК принимает врач [29,73,83,119]. В настоящее время ведутся исследования по разработке методов, способствующих расширению спектра применения РИК при условиях, являющихся в настоящий момент противопоказаниями для использования данной методики [75,95,113].
Осложнения РИК: профилактика и лечение. В результате интраоперационной обработки крови получается эритромасса, по своим качествам почти не отличающаяся от эритроконцентрата [19,32,117]. Наиболее распространёнными возможными недостатками подобной эритромассы являются наличие разрушенных Эр, бактериальная контаминация, попадание загрязняющих частиц и жидкостей из операционной раны, невозможность длительного хранения [39,46].
Отмытая эритромасса не активирует плазматические факторы свёртывания, но, тем не менее, существуют сообщения о серьезных нарушениях гемостаза у больных, которым проводилась РИК [55,57]. Авторы объясняют их присутствием конгломератов из лейкоцитов и тромбоцитов при неправильно выбранном режиме обработки эритромассы [57,85].
Для ранней диагностики активации свёртывания характерно укорочение активированного частичного тромбопластинового времени (АЧТВ). С целью избежания попадания лейкоцитарных и тромбоцитарных конгломератов рекомендуется применение на выходе современных лейкоцитарных фильтров.
Результатом недостаточной обработки эритромассы может также быть наличие в ней примеси гепарина, используемого для стабилизации раневой крови [27,40,121]. В итоге у больного развивается гипокоагуляция, ведущая к послеоперационному кровотечению [43,60,164]. Ранний диагноз подобной коагулопатии основывается на удлинении АЧТВ или тромбинового времени [11,12,25]. Эффективным средством нейтрализации свободного гепарина является протамин [25,30,72]. Кроме того, эффектом массивной кровопотери может быть резкое снижение числа тромбоцитов и развитие диссеминированного внутрисосудистого свертывания (ДВС-синдрома) [64,73,87].
Для аутокрови характерно либо полное отсутствие фибриногена, либо резкое снижение его уровня, вследствие чего она не свертывается [8,21]. Дефибринирование в значительной степени обусловлено ее контактом с серозными оболочками [42,52]. Биохимический механизм этого явления заключается в том, что плевра содержит активатор и проактиватор плазминогена, которые обеспечивают образование плазмина и процесс фибринолиза [17,18,81]. Образование плазмина и реализация его функции — это физиологические процессы, постоянно происходящие в организме [12,25,72].
Для предупреждения острого фибринолиза и связанной с ним кровоточивости рекомендуем профилактическое внутривенное введение эпсилон-аминокапроновой кислоты [13,24,156]. По данным литературы, фибринолитическая активность плазмы повышена в течение первого часа, а затем она снижается, содержание фибриногена повышается [73,91]. РИК возможна при кровопотерях, связанных с острым нарушением свертываемости (такая ситуация возникает, как правило, после гистероовариоэктомии, предпринятой по поводу развившихся осложнений) [69,85].
РИК, собранной из дренажей после операции позволяет избежать тяжелой анемии, не прибегая к услугам донора [75,84]. При этом кровотечение, как правило, останавливается самостоятельно через 2—3 часа. РИК в этих случаях не вызывает дополнительных нарушений гемостаза [8,21,27].
Система свертывания и фибринолиза крови, собираемой во время операции из серозных полостей, претерпевает существенные изменения, связанные с гипо- или афибриногенемией, тромбоцитопенией, резким повышением тромбопластической активности и увеличением активности фибринолизина [17,35,68]. Уменьшение концентрации фибриногена и количества кровяных пластинок отчасти, по-видимому, связано с потреблением их в процессе свертывания в полости, а отчасти — с разрушением в аспирационной системе [9,38].
Увеличение тромбопластической активности, вероятно с одной стороны, является следствием попадания в собираемую кровь тканевых факторов из поврежденных в ходе вмешательства тканей, а с другой стороны, может быть результатом гемолиза [7,32]. Известно, что в Эр содержатся факторы, которые, высвобождаясь при гемолизе, способны сильно сокращать время свертывания нормальной крови и время рекальцификации нормальной плазмы; значительно увеличивает потребление протромбина и с успехом заменяет взвесь тромбоцитов в тесте генерации тромбопластина [11,12,25,112].
Повышенную фибринолитическую активность собранной во время операции крови связывают с ее контактом в процессе вмешательства с серозными покровами полостей, с активирующим действием плазминогена, который поступает при этом в собираемую кровь [31,57]. Дефибринирование излившейся в брюшную полость крови происходит в результате концентрации фибриногена в сгустках, на фильтрах систем и контакте ее с серозными оболочками [62,73]. Последние содержат активаторы и проактиваторы плазминогена, который адсорбируется сетью фибрина, что ведет к превращению плазминогена в плазмин и лизису образовавшегося сгустка [64,84]. К концу первых суток показатели фибриногена, тромбоэластограммы, фибринолитической и протеолитической активности нормализуются. Содержание плазминогена в эти сроки остается сниженным [18,27].
Экспериментально установлено, что после РИК возникает умеренная гипокоагуляция крови и рекальцификации плазмы, снижении протромбиновой и тромбопластической активности, снижении толерантности к гепарину увеличении фибринолитической активности [41,167]. По данным Е. А. Вагнера с соавт. (1977), в процессе РИК во время операций на легких показатели свертывания и фибринолиза крови (время рекальцификации, толерантность к гепарину, активность протромбина, фибринолитическая активность, концентрация фибриногена) существенно не изменялись [18].
По мнению некоторых авторов РИК на фоне гипокоагуляции не вызывает глубоких сдвигов в системе гемостаза и развития клинически выраженного ДВС-синдрома [24,33]. Хотя, первоначально исследователи считали, что РИК высоких объемов обработанной крови и прямая РИК необработанной крови вызывают коагулопатию [38,46]. По данным некоторых исследователей коагулопатия возникает очень редко [63,95]. Вызывает коагулопатию, возможно, взаимодействие причин, вызывающих шок в сочетании с гипотермией и множественными трансфузиями [53,95].
Рассматривая трансфузии необработанной крови, исследователи продемонстрировали значительно лучшее качество отмытой аутокрови по сравнению с неотмытой [28,66,168]. Однако гемолиз и гемостатические дисфункции отмечались при любом виде реинфузий, но они носили временный характер. Многие авторы в своей работе пишут о безопасности РИК больших объемов аутокрови в случаях возникновения ситуаций при вмешательствах на абдоминальной части аорты, когда кровопотеря носит трудно управляемый характер [44,65,71].
Очень важен вопрос о возможности РИК в тех случаях, когда острое нарушение свертывания уже возникло [32,166]. В последнее время такие кровотечения привлекают все большее внимание хирургов, так как благодаря новым методам исследования (в частности, тромбоэластографии) их стали диагностировать чаще [64,150]. Такие кровопотери создают сложную ситуацию, вынуждая к массивным гемотрансфузиям, которые сами по себе грозят нарушением свертывания. В то же время именно при фибринолизе удается собрать большие количества аутокрови [1,13,20].
Можно ли вливать ее обратно? Ряд авторов в конце 60-х годов сообщили о РИК в случае фибринолитического кровотечения: обратное переливание не усилило фибринолиза, пациент был спасен [13,17,35]. Для коррекции подобных нарушений авторы рекомендуют инфузию тромбоконцентрата и свежей замороженной плазмы с небольшими дозами гепарина. О фактах гемоглобинурии в процессе РИК сообщают ряд авторов [49,59,72]. Осложнением переливания гемолизированной крови является гемоглобинурия, вплоть до серьёзных нарушений функции почек [51,63,146].
В случаях массивной трансфузии гемолизированной эритромассы возможно развитие острой почечной недостаточности (ОПН) [51,66]. Однако если переливалась одновременно и донорская эритромасса, нельзя исключить, что именно она явилась причиной гемолитической реакции [66,128]. Корригируется гемоглобинурия назначением щелочных растворов, диуретиков и массивной инфузионной терапией с целью удаления свободного гемоглобина с мочой [71,154].
Следует отметить, что вышеперечисленные осложнения были характерны большей частью для аппаратов предыдущих поколений, тогда как современные селл-сэйверы, при условии их правильной эксплуатации, практически лишены побочных эффектов [54]. После операции у больных может возникнуть значительная кровопотеря по дренажам из плевральной полости и полости перикарда. Эту аутокровь называют «послеоперационной» или «дренажной» кровью, она обладает высокой тромбопластической активностью, содержит больше микросгустков, чем реинфузируемая кровь, и повышенно активные и антисвертывающие компоненты [40,48]. «Дренажную» кровь можно использовать как дополнительный источник аутоэритроцитов для коррекции анемии в послеоперационном периоде [48,85].
Несмотря на крайне тяжелое состояние больных, противопоказаний к РИК в экстренной хирургии нет, по-видимому, даже в тех случаях, когда тяжесть состояния при травме не определяется кровопотерей; в том числе и терминальное состояние не является противопоказанием к РИК. Противопоказаний к РИК нет также при тяжелом состоянии, обусловленном кровопотерей [18,54,146]. До сих пор спорным остается вопрос о бактериальном загрязнении аутокрови при повреждениях полых органов брюшной и грудной полости [63,74]. По данным ряда авторов, кровь обладает бактерицидным действием, кратковременная бактериемия не приводит к каким-либо септическим осложнениям и остается стерильной до 24 часов и более, если только не поврежден общий желчный проток человека страдающего гнойным холангитом [75,86].
Данные литературы говорят, что РИК при повреждениях полых органов и осложнения связанные с этим возникают в связи с повышенным содержанием свободного билирубина [67,74]. Некоторые авторы предлагают перед проведением РИК, провести тщательную ревизию для выявления повреждения полых органов, это еще возможно при «малых кровопотерях» и в связи с нехваткой времени почти невозможна при массивных кровопотерях [59,63]. То есть, именно в тех случаях, когда нужно экстренные меры по скорейшему восстановлению ОЦК и выведению больных из глубокого геморрагического шока.
Анализ литературы показал, о возможности РИК при повреждении полых органов брюшной полости, крупных бронхов и трахеи, с удовлетворительным послеоперационным результатом [1,13,20,34]. Об этом также свидетельствуют многочисленные экспериментальные исследования [18,54,118]. Еще в 1957 г. Д. А. Арапов писал: «Опасна кровь, измененная бактериями, а не бактериемия сама по себе» [Цитата Е. А. Вагнера и соавт. (1977) [18]]. Это подтверждают экспериментальные исследования, показавшие, что тяжелые осложнения после переливания бактериально загрязненной крови возникают вследствие интоксикации организма продуктами распада крови и микробными токсинами. Более токсичной (при одинаковой степени микробного загрязнения) была кровь, находившаяся в течение 24 ч. в термостате при температуре 37 градусов. Если при переливании такой крови все животные погибали, то в опытах с переливанием инфицированной крови, хранившейся на холоде, гибели животных не наступало [54.109].
Суммируя вышеизложенное вопрос о возможности РИК при повреждениях полых органов должен решаться в пользу РИК, при отсутствии достаточного количества донорской крови и тяжелом состоянии больного как единственно возможного средства спасения и по возможности должна сочетаться добавлением одного из антибиотиков (лучше всего из ряда макролидов). Интенсивная антибактериальная терапия в раннем послеоперационном периоде позволяет предупредить развитие инфекционных осложнений [16.59]. Поэтому более целесообразнее включать РИК при повреждениях полых органов не в противопоказания как это делалось до сих пор, а к показанию к проведению РИК, хоть эти показания и «условные» (отсутствие донорской крови в достаточном количестве, тяжелое состояние больного, удовлетворительное состояние реинфузата, пребывание в полостях не более 24 часов.). Такого же мнения придерживается ряд авторов [63.65.74]. Некоторые авторы исключают из противопоказаний к РИК, операции по поводу злокачественных опухолей [20]. Доказано что опасность гематогенного метастазирования при этом ничтожна, в сравнении с оказываемым эффектом.
Кровь, излившаяся в грудную или брюшную полость, контактирует с серозными оболочками и тканями раны [35,54,141]. В излившейся крови концентрация тромбоцитов снижено в среднем на 16%, а Эр — в 2,6 раза, так как она не превышает 25% от их количества [18]. Снижено содержание Hb — на 5—10%, минимальной осмотической резистентности Эр — до 0,62 NaCl, а уровень 2,3-дифосфоглицерата в реинфузируемой крови в норме, что позволяет обеспечить достаточную оксигенацию тканей [57,142].
По данным литературы электролитный состав собираемой крови мало, чем отличается от состава электролитов циркулирующей крови [13,18]. Имеется небольшое повышение концентрации калия, что, скорее всего, связанно с гемолизом [18]. Итак, для крови, собираемой во время операции по поводу внутренних кровотечений, как правило, характерны минимальные морфологические и биохимические сдвиги. Это доказано рядом авторов [13,18,57,65,74]. Следовательно, эта кровь является полноценным резервом для возмещения массивных кровопотерь.
Таким образом, на фоне того, что идет кардинальный пересмотр вопросов трансфузии крови, к сожалению, до сих пор, РИК относится к числу еще недостаточно разработанных методов коррекции острой кровопотери. Причем, в технологическом отношении многие вопросы, включая сбор, очистка и само по себе РИК решены. Вместе с тем, к сожалению, ряд патофизиологических феноменов, связанных с морфологическими, физколлоидными, биохимическими и коагулографическими изменениями излившейся крови не обоснованы. В особенности, когда речь идет о массивных и поздних РИК. Именно этот момент является сдерживающим фактором для широкого, безопасного применения этого метода. В этом плане, кровь, излившаяся в грудную или брюшную полость, безусловно, контактирует с серозными оболочками и различными тканями, в результате чего происходят те или иные изменения, что, конечно же, отразятся на физико-химическом ее состоянии, что принципиально важно учитывать при проведении реинфузии крови (РИК).
Литературный поиск свидетельствует о том, что общими недостатками любой депонированной крови являются повреждения форменных элементов, повышенное содержание свободного Hb, опасность ее бактериального заражения, трудность собирания без сгустков, большое содержание фибриногена и тромбоцитов, высокая тромбопластическая и фибринолитическая активность, что, безусловно, отражается на состоянии больных, которым эта кровь возвращается.
В указанном аспекте, актуальным является вопрос о полноценной оценке излившейся крови для безопасной и эффективной РИК. Для этого, на наш взгляд, необходимо прояснить динамику морфологии, биохимии и каогулографии крови, излившейся в брюшную и плевральную полости в зависимости от сроков развития, соответственно, гемоперитонеума и гемоторакса. Малоизученные или же вовсе неизученные вопросы и составили предмет настоящего исследования.
Глава 2
Методология, методы и материалы исследований
Нами проведены 2 серии экспериментов на 50 кроликах обоего пола весом 3—6 кг. Краткая характеристика экспериментов приведена в таблице 2.1.
Таблица 2.1. Серии экспериментов и их краткая характеристика

Моделирование ранения груди с гемотораксом. Во-первых, моделирование ранения груди с гемотораксом и оценки физико-химического состояния аутокрови, излившейся в плевральную полость. Во-вторых, моделирование исходных физико-химических параметров аутокрови, предназначенных для ранней (2 ч) и поздней (6 ч) РИК.
Исследования проведены на 25 кроликах обоего пола массой 3—5 кг. После фиксации кролика на операционном столе и после введения анестетиков спустя 10—15 мин выполнялась мини-торакотомия по задней поверхности груди. После установления дренажной трубки в плевральном синусе пересекалась межреберная артерия, то есть создавалась картина внутриплеврального кровотечения с образованием гемоторакса. После этого межреберная артерия перевязывалась посредством прижатия к вышерасположенному ребру.
Первую порцию (через 3 мин) крови в объеме 2 мл эвакуировали шприцом для гемографического, биохимического, физколлоидного и коагулографического исследований. При этом результаты анализа служили исходными данными для оценки последующей динамики соответствующих показателей.
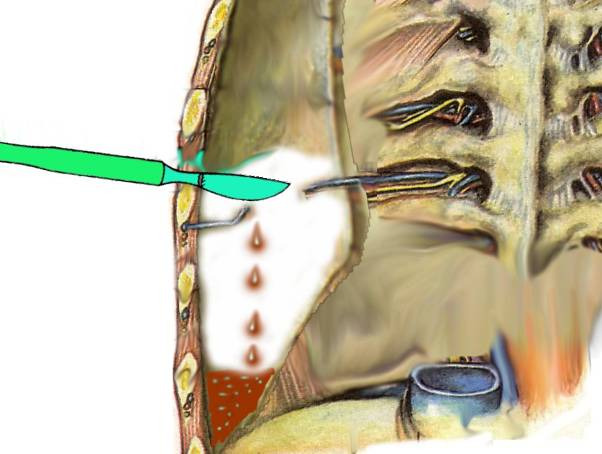
Рис. 2.1. Схема эксперимента по моделированию гемоторакса
Затем мини-торакотомная рана зашивалась до дренажной трубки, которая оставалась закрытой в течение 2-х часов, по истечению которых через дренажную трубку из плевральной полости шприцом вновь эвакуировали 2 мл скопившегося в плевральной полости порции крови для исследования. Эту процедуру повторяли также спустя 4 часа, то есть на 6-м часу моделирования гемоторакса. При этом 2-х часовый период гемоторакса условно соответствовал вероятному сроку операции у большинства пострадавших на практике ургентной хирургии, тогда как 6-и часовый период, как правило, соответствовал запоздалому сроку торакотомии.
Моделирование ранения живота с гемоперитонеумом. Во-первых, моделирование ранения живота с гемоперитонеумом и оценка физико-химического состояния аутокрови, излившейся в брюшную полость. Во-вторых, моделирование исходных физико-химических параметров аутокрови, предназначенных для ранней (2 ч) и поздней (6 ч) РИК.
Исследования проведены на 25 кроликах обоего пола массой 3—5 кг. После фиксации кролика на операционном столе и после введения анестетиков спустя 10—15 мин выполнялась мини-лапаратомия в эпигастральной области. После установления дренажной трубки в подпеченочное пространство пересекалась а.gastrica epiploica, то есть создавалась картина внутрибрюшного кровотечения с образованием гемоперитонеума. После чего, поврежденная артерия лигировалась.
Первую порцию (через 3 мин) крови в объеме 2 мл эвакуировали шприцом для гемографического, биохимического, физколлоидного и коагулографического исследований. При этом результаты анализа служили исходными данными для оценки последующей динамики соответствующих показателей. Затем мини-лапаротомная рана зашивалась до дренажной трубки, которая оставалась закрытой в течение 2-х часов, по истечению которых через дренажную трубку из брюшной полости шприцом вновь эвакуировали 2 мл скопившегося в подпеченочном пространстве порции крови для исследования.
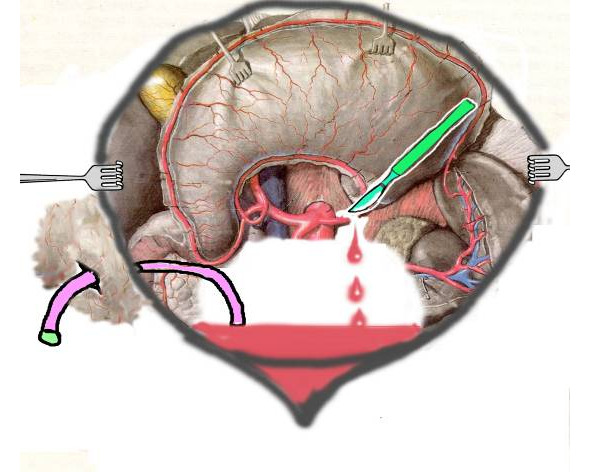
Рис. 2.2. Схема эксперимента по моделированию гемоперитонеума
Такую процедуру повторяли также спустя 4 часа, то есть на 6-м часу моделирования гемоторакса. При этом 2-х часовый период гемоперитонеума условно соответствовал вероятному сроку операции у большинства пострадавших на практике ургентной хирургии, тогда как 6-и часовый период, как правило, соответствовал запоздалому сроку лапаротомии.
Физико-химические константы крови зависят не только от клеточного состава, факторов гемостаза, но и от соотношения основных белковых фракций и электролитов. Уместно привести физические константы крови и при этом следует обратить внимание на то, что речь идет о показателях крови, «вышедших» из сосудистого русла в какую-либо серозную полость (плевральная, брюшная). Приведем лишь ориентиры вероятных причин изменения этих показателей. Надо заметить, что в доступной нам литературе мы не встретили сведений о тех или иных изменений именно излившейся в серозную полость крови.
1) Морфологическая характеристика крови, излившейся в серозную полость, осуществлялась на основе гемограммы, которая включала в себя определение: 1) концентрации Hb (г/л); 2) количества Эр (х1012/л); 3) количество лейкоцитов (х109/л); 4) количество тромбоцитов (х109/л); 5) величины Ht (%); величина ЦП.
Эритроцитоз развивается при сгущении крови, когда уменьшается объем плазмы при сохранении количества Эр, а эритроцитопения развивается в результате гемолиза. При этом важно учитывать следующие физиологические формы Hb: 1) оксигемоглобин (HbО2) — соединение Hb с кислородом образуется, преимущественно, в артериальной крови и придает ей алый цвет; 2) восстановленный гемоглобин или дезоксигемоглобин (HbH) — Hb, отдавший кислород тканям.
Снижение содержания Hb в крови (анемия) может быть следствием повышенных потерь гемоглобина при разного рода кровотечениях или повышенном разрушении (гемолизе) Эр, а повышение уровня Hb сгущении крови. Ht — это доля (%) от общего объема крови, которую составляют Эр и его повышение обуславливается гемоглобинопатией, гемоконцентрации, дегидратации, а понижение Ht в результате анемии, гипергидратации.
Лейкоциты — форменные элементы крови, отвечающие за распознавание и обезвреживание чужеродных компонентов, иммунную защиту организма от вирусов и бактерий, устранение отмирающих клеток собственного организма. Физиологическое повышение их уровня возникает при травматизации тканей, воздействии холода и тепла. Возможен реактивный физиологический лейкоцитоз за счет перераспределения пристеночного пула нейтрофилов, а лейкопения — за счет гемолиза.
2) Физколлоидная характеристика крови, излившейся в серозную полость, выполнена на основе определения следующих констант крови: 1) эритроцитарные индексы крови — MCH, MCHC, определяемые расчетным методом; 2) осмотическая резистентность Эр (%); 3) механическая резистентность Эр; 4) свободный Hb (мг%); 5) степень гемолиза (% к общему Hb).
Эритроцитарные индексы — это расчетные величины, позволяющие количественно характеризовать важные показатели состояния Эр. MCH — среднее содержание Hb в Эр (mean cell hemoglobin) Вычисляется в абсолютных единицах делением величины концентрации Hb на число Эр. Этот параметр определяет среднее содержание Hb в отдельном Эр и аналогичен ЦП, но более точно отражает синтез Hb и его уровень в Эр. На основании этого индекса анемии можно разделить на нормо-, гипо- и гиперхромные. Гипохромия обусловлена уменьшением объема Эр (микроцитоз) или снижением уровня Hb в Эр нормального объема. Повышение или понижение МСН происходит при анемии.
MCHC — средняя концентрация Hb в Эр. Рассчитывается путем деления концентрации Hb крови (в г/100 мл) на Ht и умножения на 100. Показатель отражает насыщение Эр Hb и характеризует отношение количества Hb к объему клетки. Не зависит, таким образом, от объема клетки, в отличие от МСН. Понижение МСНС происходит при анемии и гемоглобинопатии. Степень гемолиза излившейся крови стандартным методом с использованием гемометра Сали и осмотическая резистентность эритроцитов унифицированным методом в модификации Идельсона.
Определение осмотической резистентности Эр основано на изучении минимальной и максимальной степени гемолиза Эр при инкубации их в растворе различной концентрации NaCl. У здоровых лиц начало гемолиза Эр отмечался в 0,5% растворе NaCl, а полый гемолиз — в 0,3% растворе. При снижении резистентности Эр гемолиз наступает при более высокой концентрации (0,6—0,8% р-ра).
Исследование механической резистентности Эр основано на определении в плазме Hb после обработки крови в аппарате для встряхивания. У лиц контрольной группы в плазме образуется 15—30 г/л Hb. Снижение механической резистентности Эр сопровождается образованием повышенного, чем указанное числе концентрации Hb. На основании этих цифр рассчитывался % гемолиза.
3) Биохимическая характеристика крови, излившейся в серозную полость, осуществлялась на основе протеинограммы и ряда биохимических показателей крови. Протеинограмма включала: 1) общий белок (г%); 2) альбумин (г%); 3) глобулин (г%); 4) α-1-глобулин (г%); 5) α-2 –глобулин (г%); 6) β-глобулин (г%); 7) γ –глобулин (г%); коэффициент альбумин / глобулин.
Белки — органические полимеры, состоящие из аминокислот. В построении белковых молекул используется 20 различных аминокислот, последовательность и количество которых определяют размеры и свойства белка. Суммарная концентрация всех белков, а их несколько сотен, находящихся в сыворотке крови, определяется понятием «общий белок».
У здоровых людей концентрация белка в сыворотке крови может колебаться под влиянием многих причин. Снижение концентрации белка возникает, в первую очередь, при распаде. Одновременно с определением общего белка сыворотки крови проводят исследование отдельных групп белков — белковых фракций. В норме они имеют следующее соотношение: Альбумины — 54—65%, Глобулины: α-1-глобулины — 2—5%, α-2-глобулины — 7—13%, β-глобулины — 8—15%, γ-глобулины — 12—22%.
Снижение концентрации альбумина может происходить при его распаде, повышенном расходе. Наиболее частой причиной повышения концентрации α-1 и α-2-глобулинов являются различные воспалительные процессы. При этом концентрация β-глобулинов снижается. Повышение концентрации β-глобулинов отмечается при анемии. Содержание γ-глобулинов увеличивается при воспалениях, а снижение их количества — при распаде белков. Определяли следующие биохимические показатели: 1) общий билирубин (ммоль/л); 2) остаточный азот (ммоль/л); 3) мочевина плазмы (ммоль/л); 4) ионы натрия (ммоль/л); 5) ионы калия (ммоль/л).
Коагулографическая характеристика крови, излившейся в серозную полость проводилась по следующим показателям: 1) Тромбоциты (х109/л) (Fonio A.,1951); 2) Агрегация тромбоцитов (сек) (Ч.С.Гусейнов и соавт., 1971); 3) время свертывания по Ли-Уайту в силиконированной пробирке (сек); 4) время свертывания по Ли-Уайту в несиликонированной пробирке (сек); 5) каолиновое время свертывания плазмы (сек) (З. С. Баркаган и соавт, 1979); 6) каолин-кефалиновое время свертывания плазмы (сек) (Caen I.P. et al.,1969); 7) время рекальцификации плазмы (сек) (Bergernor, Roke, 1963); 8) тромбиновое времени (сек) (Биггс Р. М., Макфарлан Р. Г., 1962); 9) протромбиновое время (сек) (Квик, 1966); 10) толерантности плазмы к гепарину (мин) (Polltr, 1954); 11) фибриноген (г/л) (Рутберг Р. А., 1961); 12) фибринолиз (мин) (Kowarzyk H., Buluk K.,1954); 13) этаноловый тест (%) (Godall et al.,1971); 14) АКТ на 6 минуте (сек); 15) АКТ на 8 минуте (сек); 16) АКТ на 10 минуте (сек) [64,76,77].
Тромбоциты — форменные элементы крови, участвующие в гемостазе, которые обладают следующими способностями: к агрегации, адгезии, дегрануляции, ретракции сгустка. На своей поверхности они переносят факторы свертывания (фибриноген), антикоагулянты, биологически активные вещества (серотонин), а также циркулирующие иммунные комплексы.
Тромбоцитоз развивается при активации гемопоэза, воспалительных процессах и анемии в результате острой кровопотери или гемолиза. Тромбоцитопения развивается при анемии, ДВС-синдроме и при массивной гемотрансфузии. Адгезия и агрегация тромбоцитов позволяют обеспечивать гемостаз, за счет того, что скапливаются в области повреждения, прилипают к поврежденной стенке. Стимуляторами агрегации тромбоцитов являются тромбин, адреналин, серотонин, коллаген.
Тромбин вызывает агрегацию кровяных пластинок и образование псевдоподий. В гранулах тромбоцитов содержатся факторы свертывания, фермент пероксидаза, серотонин, ионы кальция Са2+, АДФ (аденозиндифосфат), фактор Виллебранда, тромбоцитарный фибриноген, фактор роста тромбоцитов. Ретракция кровяного сгустка — это свойство тромбоцитов к уплотнению тромба и отжатию сыворотки. При этом тромбоциты прилипают к нитям фибрина и высвобождают тромбостенин, который осаждается на нитях фибрина, в результате последние уплотняются и скручиваются, образуя первичный тромб.
Статистическая обработка материала была произведена с помощью ПК Pentium-IV с использованием пакета стандартных программ. Для изучения достоверности различий в количественных параметрах между сроками исследования и группами экспериментальных животных применялись парный и непарный t-тесты Стьюдента. Для изучения распределения дискретных признаков в сравниваемых группах применялся стандартный метод анализа сопряженности х 2 — по Пирсону.
Глава 3
Морфологическая, физколлоидная, биохимическая и гемостазиологическая характеристика крови, излившейся в брюшную полость
§1. Морфология и физколлоид крови, излившейся в брюшную полость у экспериментальных животных при моделировании ранения живота
О том, что кровь, излившейся в брюшную полость контактируется с брюшиной и тканями раны, в результате чего изменяется морфологическая ее характеристика, отмечают ряд авторов [17,27]. По мнению М. Ф. Зиньковского (1966) [41], Е.А.Вагнера и соавт. (1977) [18] и др. в основе разрушения форменных элементов крови обусловлено гемолитическими свойствами брюшины. В табл. 3.1. показана динамика морфологии крови, излившейся в брюшную полость.
Как видно из табл. 3.1., начиная уже с 3-й мин, отмечается достоверное снижение количества эритроцитов. После 6 ч пребывания крови в брюшной полости их количество уменьшается в 1,5 раза. Синхронно снижается и количество лейкоцитов в крови. Следует отметить, что подобная синхронность отмечается и в отношении ЦП, Hb и Ht. Однако, достоверность такой динамики характерно лишь для Hb и Ht.
Таблица 3.1. Гемографические показатели крови, излившейся в брюшную полость
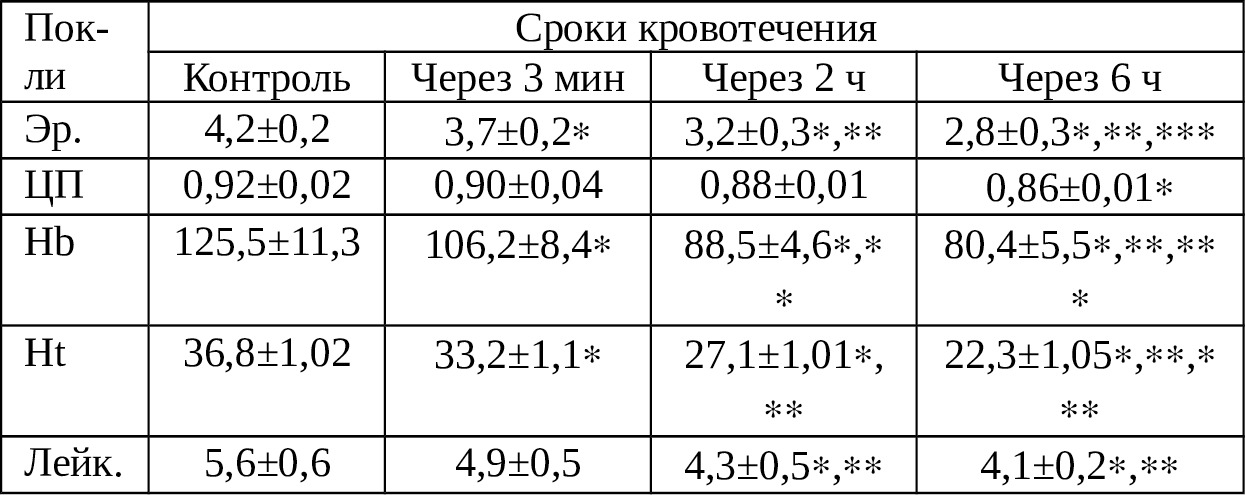
Примечание: {} — достоверно в сравнении с контролем; {}{} — достоверно в сравнении с исходным; {}{}{} — достоверно в сравнении с предыдущим сроком.
Таким образом, степень разрушаемости таких форменных элементов крови, как эритроциты и лейкоциты достаточно высокая и наши данные, касательно этого несколько отличаются от сведений ряда авторов. Так, по данным Е.А.Вагнера и соавт. (1977) удельный вес разрушенных эритроцитов в аутокрови не превышает 25%, тогда как по нашим данным уже через 6 ч этот показатель составляет 33,3% [18].
Таблица 3.2. Физколлоидные показатели крови, излившейся в брюшную полость
Примечание: * — достоверно в сравнении с исходным показателем; ** — достоверно в сравнении с показателем предыдущей порции.
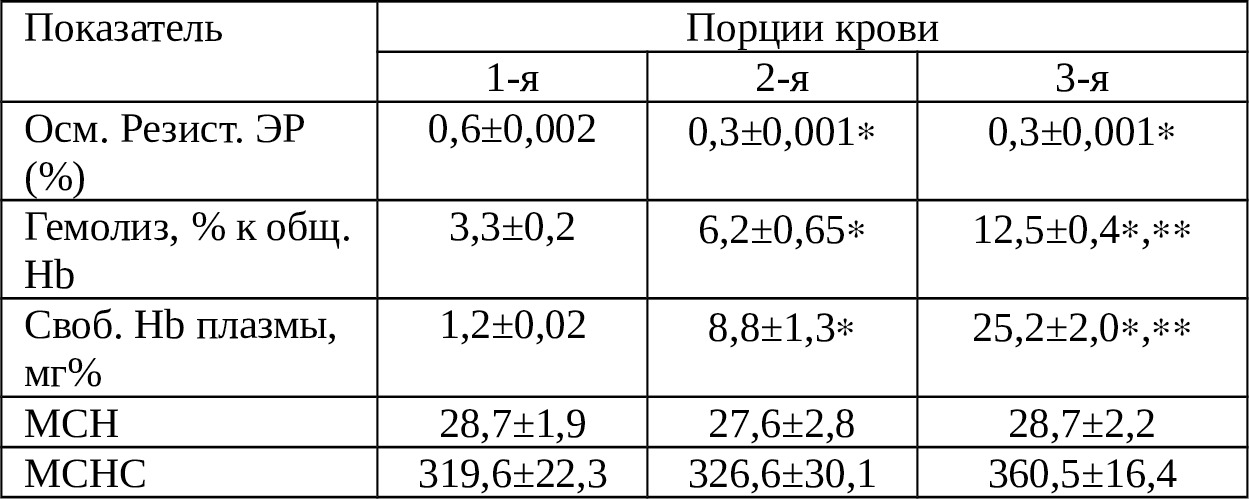
Снижение других показателей вполне объяснимо. Для более точной характеристики аутокрови, собранной с брюшной полости мы изучили ряд других характеристик. В табл. 3.2. приведена физколлоидная характеристика крови, излившейся в брюшную полость в зависимости от сроков нахождения там. 1-я порция крови — через 3 мин, 2-ая — через 2 ч и 3-я — через 6 ч.
Как видно из табл. 3.2. на фоне снижения количества Эр от порции к порции осмотическая резистентность их почти в 2 раза снижается во 2-й и 3-й порциях крови, что, по-видимому, объясняется гемолитическим действием брюшинного покрова и влиянием постепенно скапливающегося реактивного транссудата в брюшной полости. Между тем, на фоне не столь выраженного снижения количества Hb удельный вес свободного Hb плазмы резко возрастает уже через 2 ч и утраивается в промежутке от 2 до 6 ч (Р <0,05).
Соответственно, от порции к порции возрастает показатель гемолиза крови. Так, через 2 ч она возрастает до 6,2±0,65%, а еще через 4 ч — до 12,5±0,4%. Между тем, по данным Е.А.Вагнера и соавт. (1977) гемолиз не превышает в первые 6 ч — 5,3±2,8%-9,5±3,8% [18]. Таким образом, гемолиз крови, рассчитанный в отношении всего количества Hb, в сроки свыше 6 ч составляет более 12,5%, что следует учитывать при выполнении РИК.
О том, что частичный гемолиз крови не опасен доказаны еще в исследованиях А.Н.Филатова (1959), Е.Н.Мешалкина (1969) цит. Е. А. Вагнера и соавт. (1977). Дело в том, что Hb аутокрови по своей структуре идентичен белкам организма и без особых последствий выводится из организма почками [18]. В литературе сообщаются случаи, когда успешную РИК производили при концентрации свободного Hb в 300 мг% [50]. В этом плане, спустя даже 6 ч после образования гемоперитонеума концентрация свободного Hb не превышает 25мг%.
Таким образом, при гемоперитонеуме кровь, излившейся в брюшную полость сохраняет в достаточной степени свою функцию в пределах наблюдения (2—6 ч): во-первых, удельный вес разрушенных Эр не превышает 25%; во-вторых, удельный вес гемолизированной крови не превышает 12,5%; в-третьих, концентрация свободного Hb не превышает 25мг%. Однако, следует учесть тот факт, что с течением времени осмотическая резистентность Эр заметно снижается.
§2. Биохимия крови, излившейся в брюшную полость у экспериментальных животных при моделировании ранения живота
Ряд авторов задавались вопросом: насколько изменяется биохимия крови, излившейся в брюшную полость? Эта кровь контактируется с брюшинным покровом органов и тканями раны, в результате чего, как это показано в предыдущем разделе главы, изменяется морфологическая ее характеристика. Безусловно, надо предполагать, что это должна сопровождаться биохимическими изменениями.
Как видно из табл. 3.3. концентрация общего белка постепенно снижается. Чем дольше срок нахождения крови в брюшной полости, тем ниже содержание белка. По-видимому, часть белка осаждается на брюшинном покрове или разрушается. Между тем, белки, особенно альбумины, играют очень существенную роль в поддержании нормальной осмотической резистентности форменных элементов крови. Падение их, бесспорно, сопровождается снижением резистентности, а, следовательно, способствует нарастанию удельного веса разрушенных форменных элементов.
Таблица 3.3. Протеинограммные показатели крови, излившейся в брюшную полость
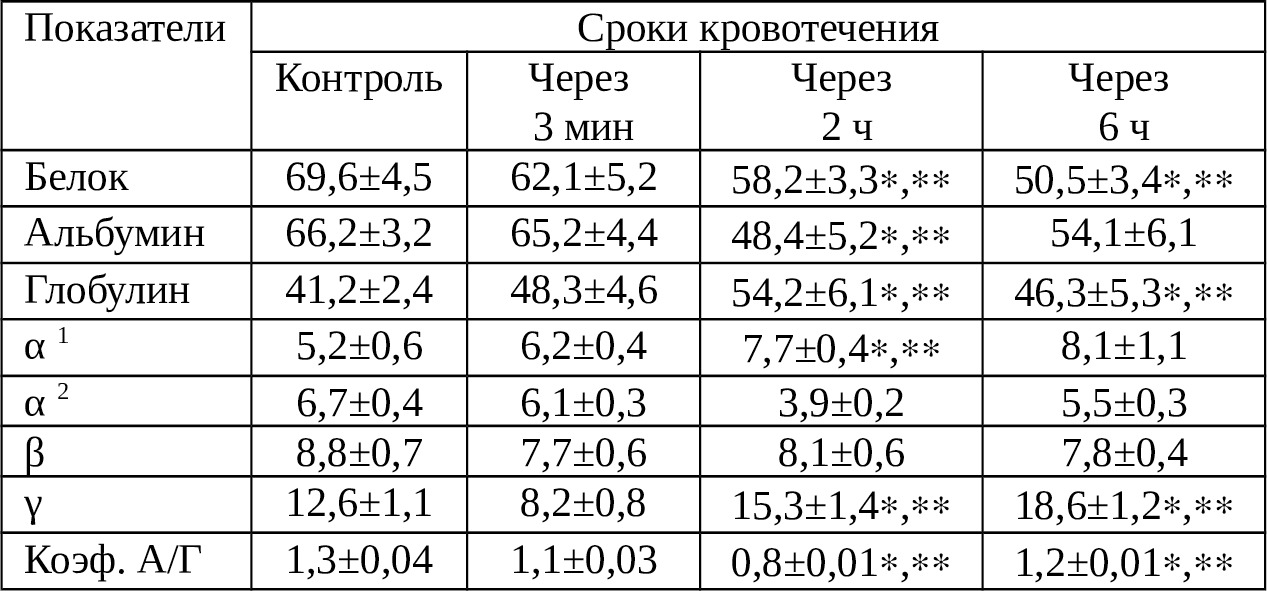
Примечание: * — достоверно в сравнении с контролем; ** — достоверно в сравнении с исходным; *** — достоверно в сравнении с предыдущим сроком.
Характерным, является изменение соотношения альбуминовой и глобулиновой фракций. Если судить по коэффициенту А/Г, то заметно, что через 2 ч содержание глобулина превышает таковое альбумина (коэфф. А/Г — 0,8), тогда как еще через 4 ч нормальное соотношение альбумина и глобулина почти восстанавливается (коэфф. А/Г — 1,2). Причем, относительное увеличение глобулиновой фракции наступает на фоне снижения альбумина в сроки 2 ч за счет α1 и γ-фракций. Возможно, увеличение γ-глобулинов, которые представляют собой антитела — есть реакция уже излившейся крови на раздражения со стороны брюшины спланхнических органов и тканей раны.
Следует отметить, что при анализе протеинограммы речь должна идти лишь о подобной реакции излившейся крови с характерным изменением соотношения той или иной фракции или частичном распаде белков крови и вероятных последствиях диспротеинемии. В этом смысле, полученные данные необходимо анализировать в совокупности с другими биохимическими показателями. В табл. 3.4. показана динамика ряда биохимических показателей крови, излившейся в брюшную полость.
Как видно из нее, концентрация билирубина остается почти на одинаковом уровне в первые 6 ч. Экспериментально доказано, что гемолизированная аутокровь не сопровождается чрезмерным увеличением концентрации билирубина [54]. Надо заметить, тем не менее, в результате распада форменных элементов, изменения концентрации белка в излившейся крови наступает высвобождение ионов калия (до 6 мг%), увеличение содержания остаточного N (до 28,2 мг%) и мочевины (до 10—12,6 мг%). Такая динамика объяснима. Дело в том, что начавшейся распад форменных элементов и белков крови продолжается, а утилизация продуктов распада не происходит.
Таблица 3.4. Биохимические показатели крови, излившейся в брюшную полость
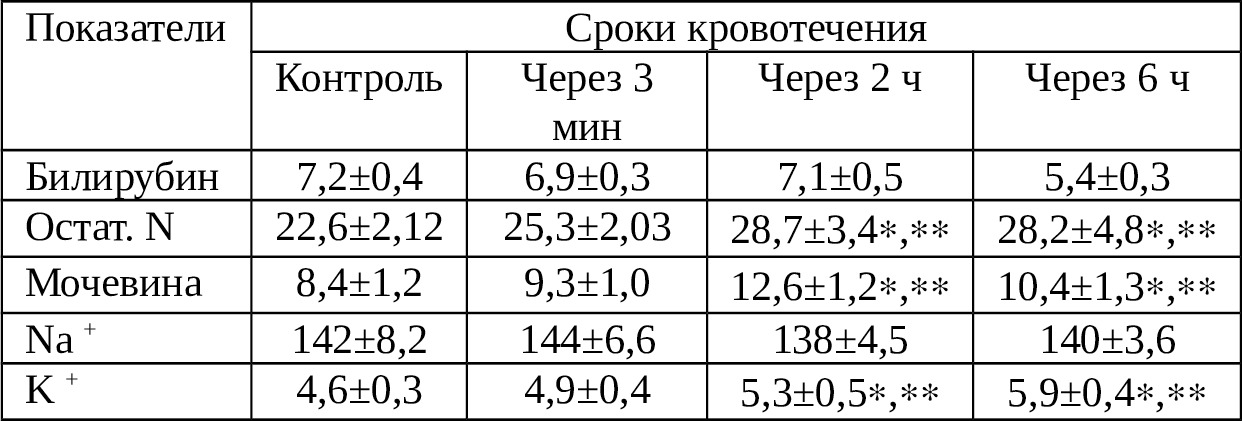
Примечание: * — достоверно в сравнении с контролем; ** — достоверно в сравнении с исходным; *** — достоверно в сравнении с предыдущим сроком.
Хотим вновь заострить внимание на тот факт, что речь не идет о снижении процесса мочевинобразования, что должно происходить в печени, о снижении метаболизм в печени с исходом в гипопротеинемии, гипофибриногенемии, а речь идет об оценке биохимических последствий распада форменных элементов и белков крови, излившейся в брюшную полость. Таким образом, в результате известных процессов в излившейся крови отмечается более высокая концентрация ионов калия, остаточного азота и мочевины.
Важно отметить, что эти изменения являются, как уже отмечалось выше, биохимическими последствиями распада форменных элементов и белков крови и, в то же время, сами могут провоцировать дальнейший процесс распада. И эту закономерность следует обязательно учитывать при оценке пригодности крови, собранной из брюшной полости, для целей РИК.
§3. Гемостазиология крови, излившейся в брюшную полость у экспериментальных животных при моделировании ранения живота
Имеются ряд детальных исследований показателей гемостаза крови, излившихся в серозные полости организма [41,46]. По данным авторов наступает первичная активация свёртывания либо фибринолиза, что может вызывать расстройство гемокоагуляции у больных после РИК. Клинический интерес представляет вопрос о том, какие изменения наступают в состоянии тромбоцитарного гемостаза, в системе свертываемости крови и фибринолиза в крови, излившейся в брюшную полость?
В табл. 3.5. приведены расширенные гемостазиограммы крови, излившейся в брюшную полость в зависимости от сроков гемоперитонеума. В целом, следует подчеркнуть разнонаправленность основных показателей каогулограммы. Как видно из этой таблицы, количество тромбоцитов достоверно снижается, особенно в 6 часовый срок (до 180±10,2 против исходного 288±11,6). Процесс агрегации замедляется почти в 2 раза уже через 2 ч.
Надо заметить, что время агрегации растянут до 40±2,2 сек, а в процессе наблюдения (2—6 ч) агрегации замедляется, однако, в сравнении с цельной кровью длительность агрегации продолжает оставаться растянутой. Отмечается закономерное снижение процессов гемостаза. В частности, свертываемости крови, о чем свидетельствует время свертываемости по Ли-Уайту. Причем, как в силиконированной, так и не в силиконированной пробирках.
Каолиновое время составило к исходному моменту, 55,6±7,7 сек, тогда как спустя 2 ч — 37,3±3,6 сек, а к исходу 6 ч — 33,2±2,2 сек. Каолин-кефалиновое время свертывания плазмы изменяется аналогично, то есть достоверно и постепенно укорачивается.
Надо отметить, что время рекальцификации плазмы уменьшается в 1,2 раза через 2 ч наблюдения и в 1,5 раза через 6 ч, в сравнении с исходным показателем (Р <0,05 и Р <0,05).
Динамика тромбинового и протромбинового времени также синхронны. Наступает их укорочение, соответственно до 20,2±3,1 сек (через 6 ч) против исходного 37,7±2,4 сек (Р <0,05) и до 16,8±2,2 сек (через 6 ч) против исходного 26,2±3,3 сек (Р <0,05). К 6 ч толерантность плазмы к гепарину достоверно снижается в 2 раза (Р <0,05).
Таблица 3.5. Коагулографические показатели крови, излившейся в брюшную полость
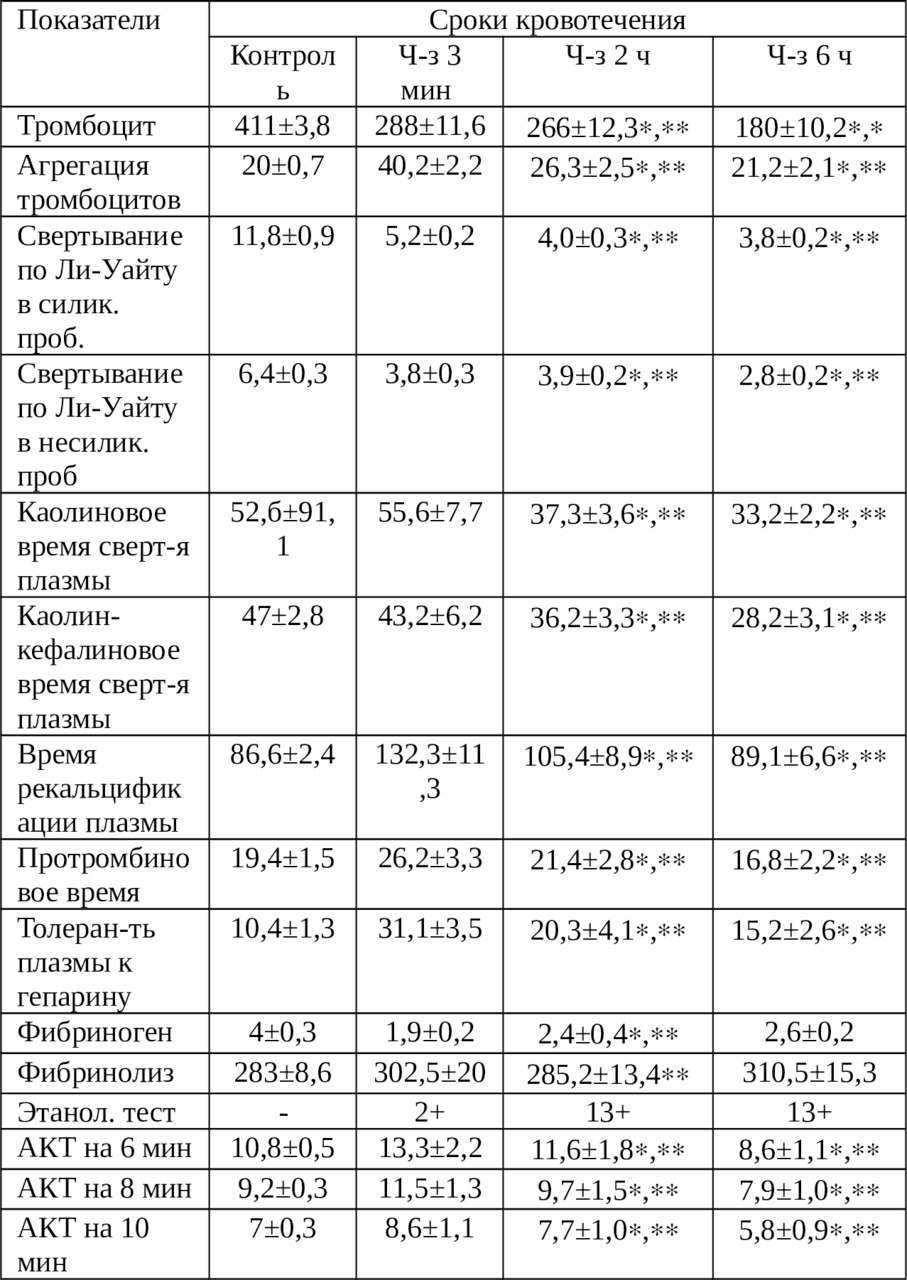
На таком фоне содержание фибриногена постепенно возрастает будучи 1,9±0,2 г/л через 3 мин после кровотечения до 2,4±0,4 г/л через 2 ч (Р <0,05) и до 2,6±0,2 г/л через 6 ч (Р> 0,05). Надо отметить тот факт, что АКТ во все сроки реакции (6,8 и 10 мин) синхронно укорачиваются.
Таким образом, с течением времени (2—6 ч) при гемоперитонеуме, в крови, излившемся в брюшную полость происходят разнонаправленные изменения. То есть, как в сторону гипокоагуляции (тромбоцитопения; замедление процесса агрегации), так и в сторону гиперкоагуляции (укорочение каолинового и каолин-кефалинового времени свертывания плазмы; уменьшение времени рекальцификации плазмы; укорочение тромбинового и протромбинового времени; снижение толерантности плазмы к гепарину; увеличение содержания фибриногена; синхронное уменьшение времени АКТ).
В крови, излившейся в брюшную полость, нарушается биологически целесообразная взаимосвязь между различными компонентами гемостаза, что проявляется в асинхронизации многоступенчатого, каскадного ферментного процесса.
Между сроком гемоперитонеума и характером изменения в системе гемостаза в крови, собранной из брюшной полости существует четкая связь. Бесспорно то, что трудно объяснить разнонаправленность этих изменений, как в сторону гипокоагуляции, так и в сторону гиперкоагуляции.
Вероятно, эти изменения связаны с реакцией на продукты распада и деградации фибрина под воздействием реакции брюшины и тотальным нарушением внутренних и внешних механизмов гемостаза.
Глава 4
Морфологическая, физколлоидная, биохимическая и гемостазиологическая характеристика крови, излившейся в плевральную полость
§1. Морфология и физколлоид крови, излившейся в грудную полость у экспериментальных животных при моделировании ранения груди
Изучение литературных данных свидетельствует о том, что кровь, излившейся в плевральную полость, контактируясь с плеврой и тканями раны, безусловно, трансформируется с изменениями в области морфологии, биохимии и гемостаза [42,53]. По мнению ряда исследователей в основе разрушения форменных элементов крови, излившейся в плевральную полость, лежат те же механизмы, что было сказано в предыдущей главе наших исследований, а именно гемолитические свойства серозного эпителия [93]. В табл. 4.1. показана динамика морфологии крови, излившейся в плевральную полость.
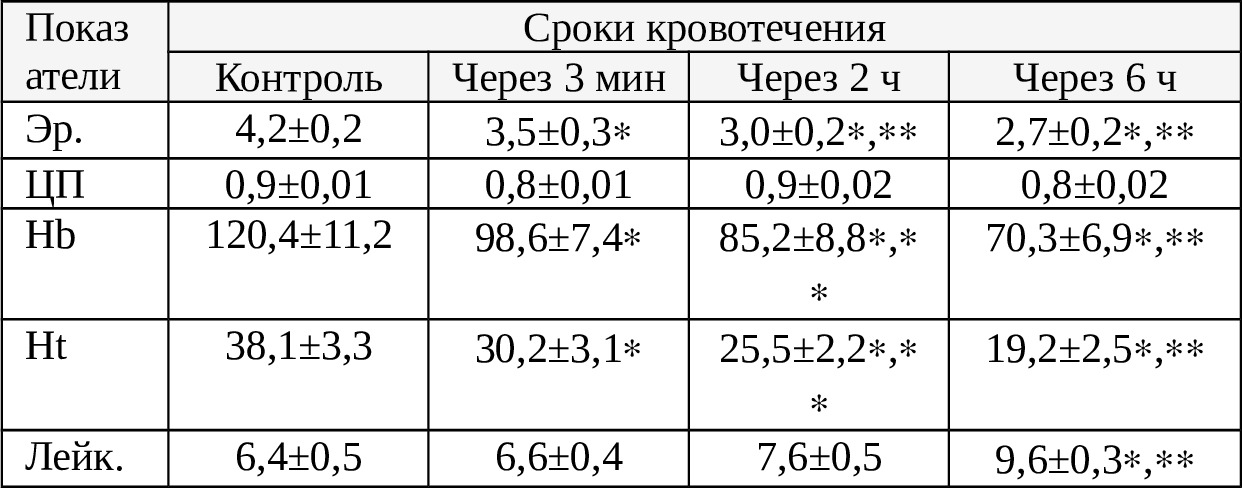
Таблица 4.1. Гемографические показатели крови, излившейся в плевральную полость
Примечание: {} — достоверно в сравнении с контролем; {}{} — достоверно в сравнении с исходным; {}{}{} — достоверно в сравнении с предыдущим сроком.
Как видно из табл. 4.1. отмечается постепенное, достоверное снижение количества Эр, что заметно даже на 3-й мин гемоторакса. Как и при гемоперитонеуме спустя 6 ч у больных с гемотораксом количество Эр уменьшается в 1,5 раза (Р <0,05). Напротив, количество лейкоцитов в крови постепенно возрастает, чего не наблюдалось при гемоперитонеуме даже спустя 6 ч. Кроме того, ЦП практически не уменьшается. Между тем, содержание Hb и число Ht достоверно уменьшаются.
Таким образом, степень разрушаемости Эр в крови, излившейся в плевральную полость высокая и наши данные, касательно этого, как впрочем, касательно степени разрушаемости Эр в крови, излившейся в брюшную полость несколько отличаются от данных многих авторов.
В частности, Е.А.Вагнера и соавт. (1977) утверждают, что удельный вес разрушенных Эр в аутокрови не превышает 25% [18], об этом мы указывали в главе 3. Согласно нашим данным удельный вес разрушенных Эр в крови, излившейся в плевральную полость, в среднем, на 10—12% больше, нежели чем в крови, собранной из брюшной полости, составляя 35,8%.
Мы провели и следующую характеристику аутокрови, собранной с плевральной полости: 1) осмотическая резистентность ЭР в %; 2) механическая резистентность Эр; 3) удельный вес гемолиза (% к общему Hb); 4) свободный Hb плазмы в %; 5) МСН; 6) МСНС.
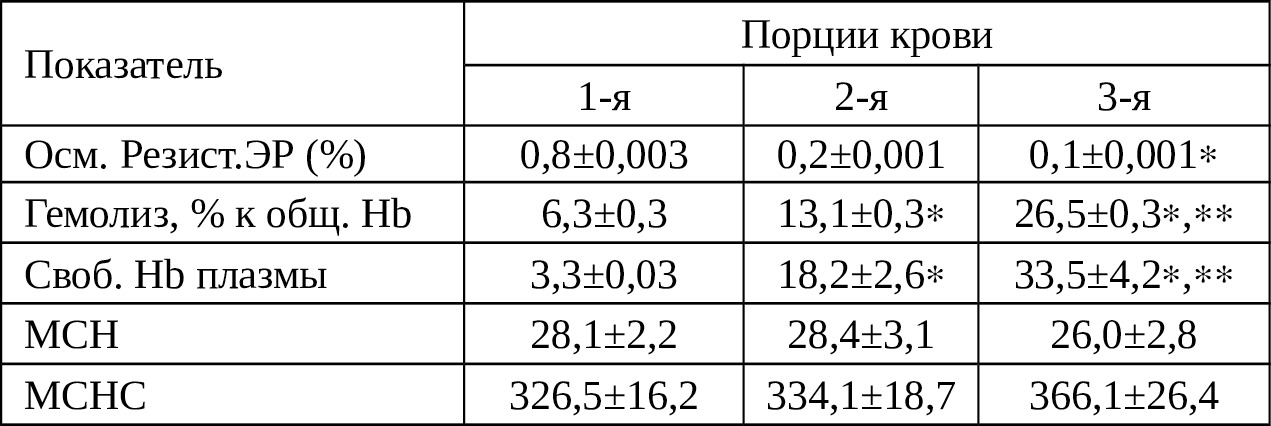
Таблица 4.2. Физколоидные показатели крови, излившейся в плевральную полость
Примечание: * — достоверно в сравнении с исходным показателем; ** — достоверно в сравнении с показателем предыдущей порции.
В таблице 4.2. приведена физколлоидная характеристика крови, излившейся в плевральную полость в зависимости от сроков нахождения там. 1-я порция крови — через 3 мин, 2-ая — через 2 ч и 3-я — через 6 ч. Как видно из таблицы 4.2. в условиях постепенного снижения количества Эр в излившейся крови, осмотическая резистентность их резко снижается, соответственно, в 4 и 8 раза в сроки 2 и 6 ч (Р <0,05 и Р <0,05).
Таким образом, градиент снижения осмотической резистентности Эр в 2—3 раза превышает таковое в крови, излившейся в брюшную полость (см. глава 3). Следовательно, гемолитическое действие плевры и влияние постепенно скапливающегося реактивного экссудата в плевральной полости больше. На таком фоне снижение количества Hb не столь выраженное, чем в крови, собранной из брюшной полости в эти же сроки исследования. Однако, удельный вес свободного Hb плазмы и показатель гемолиза значительно высокое, нежели в крови, излившейся в брюшную полость (Р <0,05 Р <0,05).
Таким образом, гемолиз крови, рассчитанный в отношении всего количества Hb, в сроки свыше 6 ч составляет 26,5±0,3%, а количество свободного Hb составляет 33,5±4,2%, что в среднем на 10—15% больше, чем таковые при гемоперитонеуме. Тем не менее, надо полагать, при гемотораксе кровь, излившейся в плевральную полость сохраняет свои функции в пределах наблюдения (2—6 ч), но они менее полноценны, чем кровь, собранная из брюшной полости.
При РИК крови, излившейся в плевральную полость, следует учесть следующие обстоятельства: во-первых, удельный вес разрушенных Эр достигает 35,8%; во-вторых, удельный вес гемолизированной крови составляет 26,5%; в-третьих, концентрация свободного Hb достигает 33,5%; в-четвертых, осмотическая резистентность Эр резко снижается уже через 2 ч.
§2. Биохимия крови, излившейся в грудную полость у экспериментальных животных при моделировании ранения груди
Безусловно, разрушение форменных элементов крови вызывает изменение биохимии крови [94]. Какова тенденция этих изменений? В таблице 4.3. показана динамика содержания белок и белковых фракций крови, излившейся в брюшную полость.
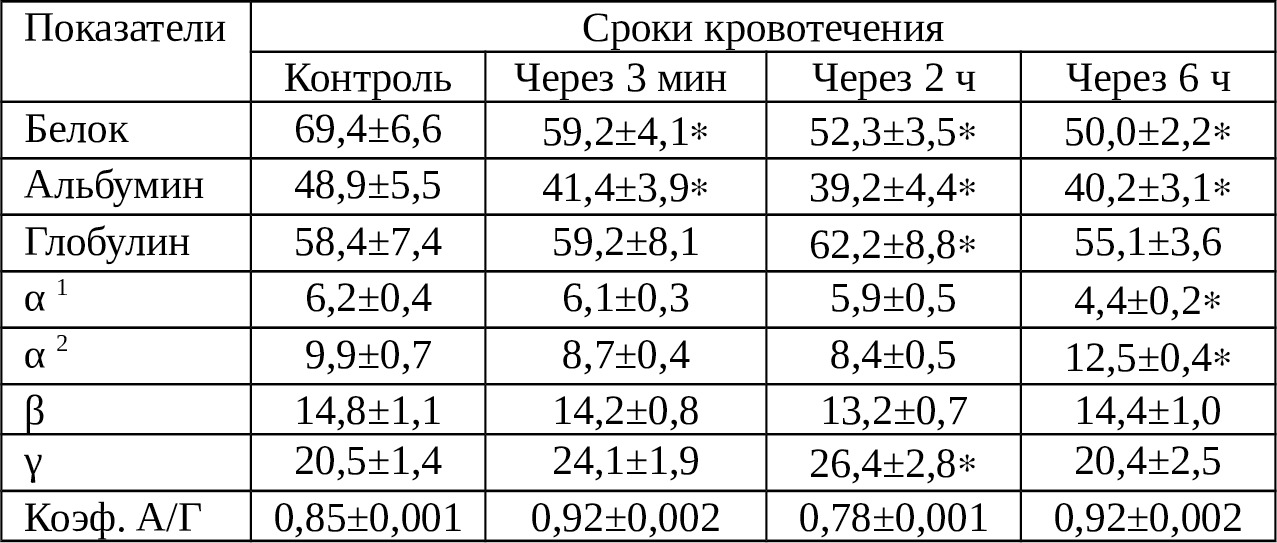
Как видно из табл. 4.3. содержание общего белка снижается. Причем, чем дольше срок нахождения крови в плевральной полости, тем ниже этот показатель. Мы придерживаемся, версии о том, что часть белка осаждается на поверхности плевры, часть подвергается разрушению. С учетом того, что белки, в особенности альбуминовая фракция поддерживают осмотическую резистентность форменных элементов крови, то их снижение, конечно же, сопровождается увеличением степени разрушения их.
Таблица 4.3. Протеинограммные показатели крови, излившейся в плевральную полость
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.