
Бесплатный фрагмент - Химия. 8 класс за 2 недели. Учебник — интерактивная тетрадь
14 уроков с нуля до написания реакций
Привет!
Перед тобой необычный учебник — это интерактивная рабочая тетрадь, которая поможет тебе освоить курс химии 8 класса за 2 недели.
Важно идти последовательно и ничего не пропускать. Знания одной темы пригодятся в следующей.
Это база, на которую ты сможешь опираться, сдавая аттестации и наслаивая на неё всё новые и новые знания по химии.
Учебник разбит на уроки, которые содержат:
Краткий конспект темы, разбор примеров, алгоритмы, задания и схемы-помогалки. Для понимания сложных моментов я сняла видео.
В тексте ты найдёшь КРАСНУЮ ПАСТУ. Красная паста — это особые моменты, на которые надо обратить пристальное внимание и запомнить.
Возьми красный карандаш и прямо в учебнике выдели эти строчки. Так ты активизируешь зрительную память.
Так же в печатном варианте оставлено место для выполнения заданий.
Дополняй конспекты, делай заметки и выполняй домашнее задание прямо в книге. Отмечай цитаты, делай закладки в электронном учебнике.
Если перед тобой электронная книга, то выписывай красную пасту в тетрадь или делай карточки.
Для лучшего восприятия материала в учебнике находятся ссылки на мои видео. Они помогут тебе разобраться и запомнить важные моменты. Если ты занимаешься по электронной версии, просто переходи по ссылке в тексте. Если с печатной — наведи камеру на QR код.
Чтобы получить доступ к видео прямо сейчас, присоединись к каналу с материалами к учебнику, введи в строке поиска Телеграмм: «Материалы к учебнику Химия 8 класс за 2 недели Анастасии Повышевой». Нажми кнопку присоединиться.
Проговаривай сложные моменты и учи номенклатуру вслух — так ты задействуешь и слуховую память.
Придумывай ассоциации, смотри опыты, пиши реакции, рассказывай и объясняй темы родителям и друзьям, и даже коту:)
И ты увидишь, насколько твои знания по химии станут уверенными, а наука окажется не такой уж и страшной.
Химию можно понять и сдать. Отличной химии.
Анастасия Олеговна Повышева
Этот раздел для тех, кто начинает химию с самого-самого нуля.
В химии есть понятие химического элемента и многие из вас знают, что существует специальная система и таблица химических элементов Дмитрия Ивановича Менделеева, великого русского химика.
Открой последнюю страницу учебника, там находится «Приложение» — список прямых ссылок. По первой ссылке ты найдёшь вариант периодической системы химических элементов (Таблицы Менделеева) для скачивания и печати.
Вид таблицы Менделеева может быть совершенно разным: цветной вариант и чёрно-белый, длинный и короткий, интерактивный и самый лаконичный. (Посмотри, какой вид имела таблица, составленная именно Дмитрием Ивановичем Менделеевым — вторая ссылка в Приложении).
Какой бы ни был вид периодической системы, неизменно следующее:
У каждого элемента в таблице есть свой дом (ячейка), название и символ.
Как работать с таблицей я обязательно покажу, но первая задача — это научиться произносить названия химических элементов и писать их символы.
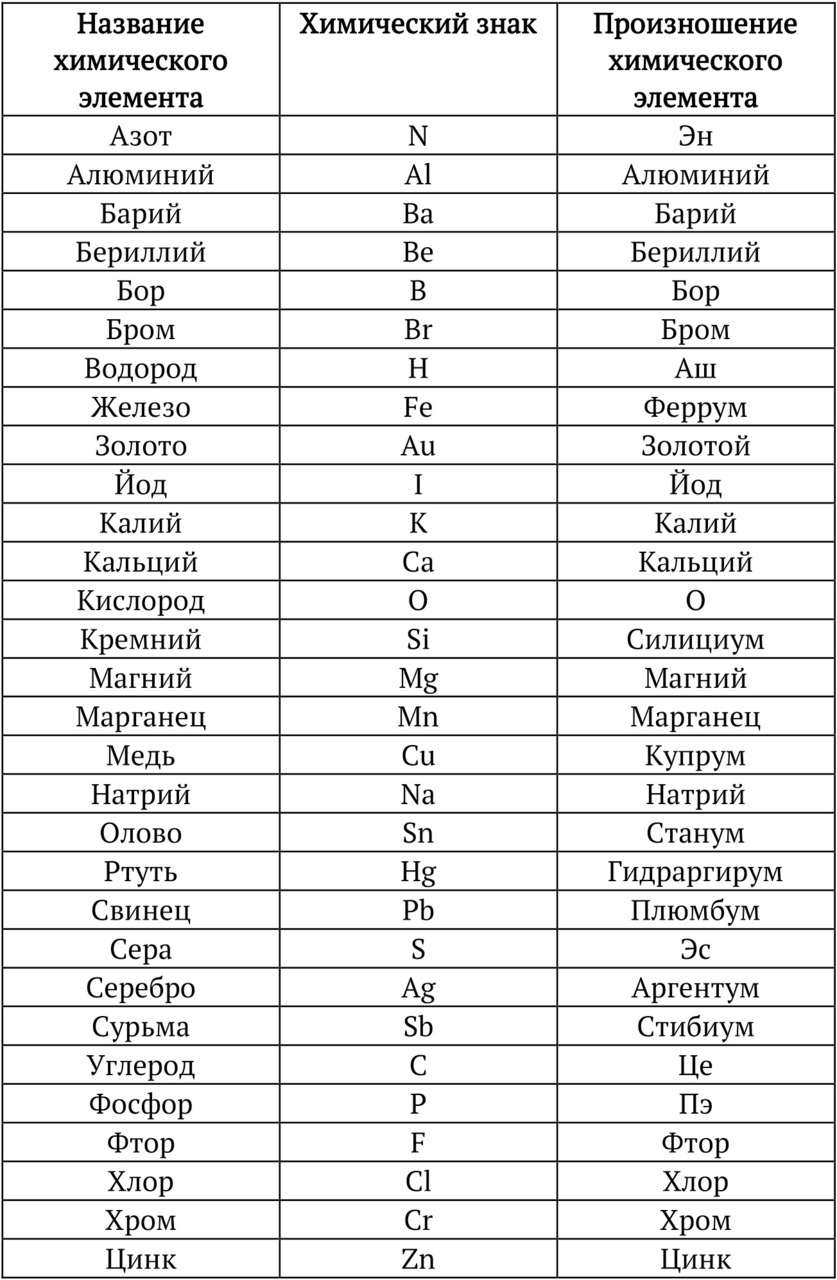
Названия и символы элементов
Символ элемента состоит из первой буквы или первой и одной из следующих букв латинского названия этого химического элемента.
Первая буква всегда прописная (заглавная), вторая — строчная.
Элемент имеет латинское название и национальное (в нашем случае — на русском языке).
Например, латинское название водорода — Hydrogenium (в переводе — «рождающий воду»), обозначение Н, цинка — Zincum, обозначение Zn.
Сразу успокою, что латинские названия учить не надо (почти).
А что надо уметь?
Правильно называть элемент по-русски и записывать формулы химических веществ через символы химических элементов.
Существуют следующие правила записи и произношения:
1. Если символ элемента одна буква — мы называем только букву.
О — произносим «о», N — произносим «эн»
КРАСНАЯ ПАСТА — исключения:
В — бор (произносим «бор»)
F — фтор (произносим «фтор»)
К — калий (произносим «калий»)
I — йод (произносим «йод»)
Есть и другие элементы, которые обозначаются одной буквой и произносятся названием целиком, но в рамках школьной программы вы будете с ними встречаться очень редко. (Например, вольфрам, ванадий и др.)
2. Если символ состоит из двух букв, то чаще мы называем его так, как он записан в таблице:
Сr — хром, произносим «хром»
Mg — магний, произносим «магний»
КРАСНАЯ ПАСТА — Исключения 10 элементов:
Кремний — произносим «силициум»
Железо — «феррум»
Медь — «купрум»
Мышьяк — «арсиникум»
Олово — «станум»
Ртуть — «гидраргирум»
Свинец — «плюмбум»
Серебро — «аргентум»
Золото — «аурум»
Сурьма — «стибиум»
Задание:
1. Найди в таблице символы этих десяти элементов и запиши их рядом с названиями.
С помощью символов записываются формулы химических веществ.
Химическая формула — это условная запись вещества с помощью символов и индексов.

Если в химической формуле есть скобки, то смотрим на индекс, который стоит после скобки.
Произносим «дважды», «трижды».
Например,
Ca (OH) 2 — произносим «кальций о аш дважды»
Обрати внимание, что индекс 2 в этой формуле относится ко всей скобке: в составе один атом кальция, два атома кислорода и два атома водорода.
Al2 (SO4) 3 — произносим «алюминий два эс о четыре трижды»
Задание:
1. Перейди в Приложение, пункт 3. Посмотри видео, перейдя по ссылке или наведя камеру телефона на QR код, и запиши формулами произнесённые вещества.

2. Выполни обратное задание, прочитай формулы написанных в предыдущем задании веществ.
3. Запиши химические формулы веществ, если известно, что их молекулы образованы:
— двумя атомами азота и тремя атомами кислорода
— тремя атомами калия, одним атомом фосфора и четырьмя атомами кислорода
— двумя атомами водорода и одним атомом серы
Получилось?
Поздравляю, можешь смело говорить, что ты знаешь много латинских слов.
Прикрепляю табличку, чтобы можно было распечатать и запоминать. Можешь выделить цветом исключения.
Начинаем.
На курсе «Химия. 8 класс за 2 недели» первым заданием я всегда даю решить тест.
Так ты зафиксируешь свой старт. И если этот старт — 0 баллов, тем приятнее в конце изучения будет получить максимум.
Второе задание — важно поставить цель. Для чего ты это всё делаешь?
Одно из прекрасных взрослых качеств — это самостоятельность. Оно открывает массу возможностей.
Это важно.
Попробуй сформулировать чёткую цель. Для чего ты работаешь с этим учебником?
Получить пятерку в конце года?
Пересдать тему? Сдать ОГЭ на 35 баллов?
Разобраться в такой сложной химии, чтобы поступить в медицинский и стать стоматологом?
Когда будешь формулировать цель, добавь следующие компоненты:
• дата (к какому числу ты хочешь достичь поставленных задач)
• что именно планируешь достичь (например, я напишу итоговый тест на максимум баллов, я научусь расставлять коэффициенты или составлять уравнения реакций быстро и без ошибок и тд)
Напиши в тетради (если работаешь с онлайн учебником) или прямо здесь всё, чего хочешь достичь.
(В конце вернись на эту страничку и посмотри на цель. Я уверена, ты будешь доволен собой).
Урок 1. Вещества и явления. Химические превращения
Химия — наука о веществах и их превращениях.
(Краткое, но ёмкое определение химии)
Сегодня поговорим о явлениях и превращениях.
Различные явления происходят повсюду и постоянно. В организме человека происходят сразу сотни биохимических процессов. В забытой на столе чашке с молоком начинается процесс скисания — это превращение. В работающем двигателе автомобиля тоже происходит превращение — бензин превращается в другие вещества с образованием энергии.
Выделяют несколько типов явлений:
1. Физические
2. Химические
3. Биологические
4. Физико-химические
Важно научиться понимать и различать данные явления и превращения.
Рассмотрим несколько примеров.
Физическое явление.
Вы решили сварить пельмени. Набрали в кастрюлю воду и поставили на плиту. Через некоторое время вода закипит и начнет испаряться. Происходит переход воды из жидкого состояния в газообразное.
Обратим внимание, что нового вещества никакого не образовалось. Вода осталась водой.
Это физическое явление.
Химическое явление (превращение).
Проведем эксперимент.
Для этого нам понадобятся:
Пищевая сода.
Лимонная кислота, предварительно растворенная в воде или уксус (например, 3%).
Ход эксперимента:
Возьмём половину чайной ложки соды и поместим на тарелку или в стаканчик.
Теперь на соду капнем раствором лимонной кислоты. Начинается реакция, происходит шипение, появляются пузырьки — бурное выделение газа. При добавлении новых порций кислоты, сода полностью «исчезнет».
Сравним два явления. В первом опыте с пельмешками вода осталась водой, изменив лишь своё агрегатное состояние. А вот в эксперименте с содой произошло выделение газа — совсем другого, нового вещества.
Произошла химическая реакция.
На основании чего мы делаем вывод о химической реакции?
Говорят о признаках химической реакции.
1. Выделение газа (не путать с испарением)
2. Выпадение осадка (возможно растворение осадка)
3. Изменение цвета, запаха
4. Выделение (поглощение) тепла, света
Итак, главное отличие физического явления от химического:
Во время химической реакции (превращения) ОБРАЗУЮТСЯ НОВЫЕ ВЕЩЕСТВА, а во время физических явлений новых соединений не появляется.
Задание:
1. Если любишь эксперименты, попробуй провести опыт, описанный в главе.
2. Запиши по 3 физических и химических явлений (превращений) из жизни.
• Физические явления:
• Химические превращения:
3. Прочитай два высказывания. Что будет физическим, а что химическим явлением? Ведь цвет изменяется и там и там.
А. На палитру сначала поместили зелёную акварель, а затем добавили красную. В результате получилась коричневая краска.
Б. Спиртовой раствор йода окрашен в бурый цвет. Если каплю такого раствора добавить в крахмал (белого цвета), то окраска становится сине-фиолетовой. Происходит ли при этом химическое превращение? Этот опыт можно провести дома.
4. Подчеркни химические явления:
Горение нефти, испарение растворителя, измельчение пряностей в ступке, образование тумана, раскатка теста для булочек, выпечка хлеба, разбрызгивание ароматизатора.
Какие признаки химических явлений наблюдаются при этом?
Вещества и превращения. Вещество.
Вещества окружают нас везде: человеческий организм состоит из органических и неорганических веществ. Стол, телефон, ручка, тетрадь — это тела, которые состоят из химических соединений и смесей веществ.
Вещество в свою очередь состоит из атомов и молекул.
Любое вещество можно записать в виде определенной химической формулы через символы химических элементов, которые указаны в таблице Менделеева.
Также каждое вещество можно описать по его свойствам: физическим (агрегатное состояние, цвет, запах и др) и химическим (в какие взаимодействия вступает).
Кислород:
Формула О2 — газ, без цвета, без запаха, имеет определенную плотность и температуру кипения и т. д.
Любое вещество мы можем описать и охарактеризовать.
Внешний вид и названия некоторых веществ необходимо запомнить, в этом тебе поможет таблица «Внешний вид и физические свойства неорганических веществ».
По ссылке ниже ты найдешь эту таблицу в цвете. Чтобы получить безлимитный доступ к материалам, присоединись к Телеграмм каналу «Материалы к учебнику Химия 8 класс за 2 недели», так все ссылки из учебника станут активными.

Для быстрого и удобного запоминания можешь воспользоваться моими готовыми карточками или сделать их самостоятельно.
Можешь раскрасить таблицу прямо здесь, в учебнике. Как я показала по ссылке выше.
Так ты задействуешь свою зрительную память и навсегда запомнишь цвет некоторых веществ.
В свободном месте можешь добавлять вещества, которые будут тебе встречаться в курсе химии.
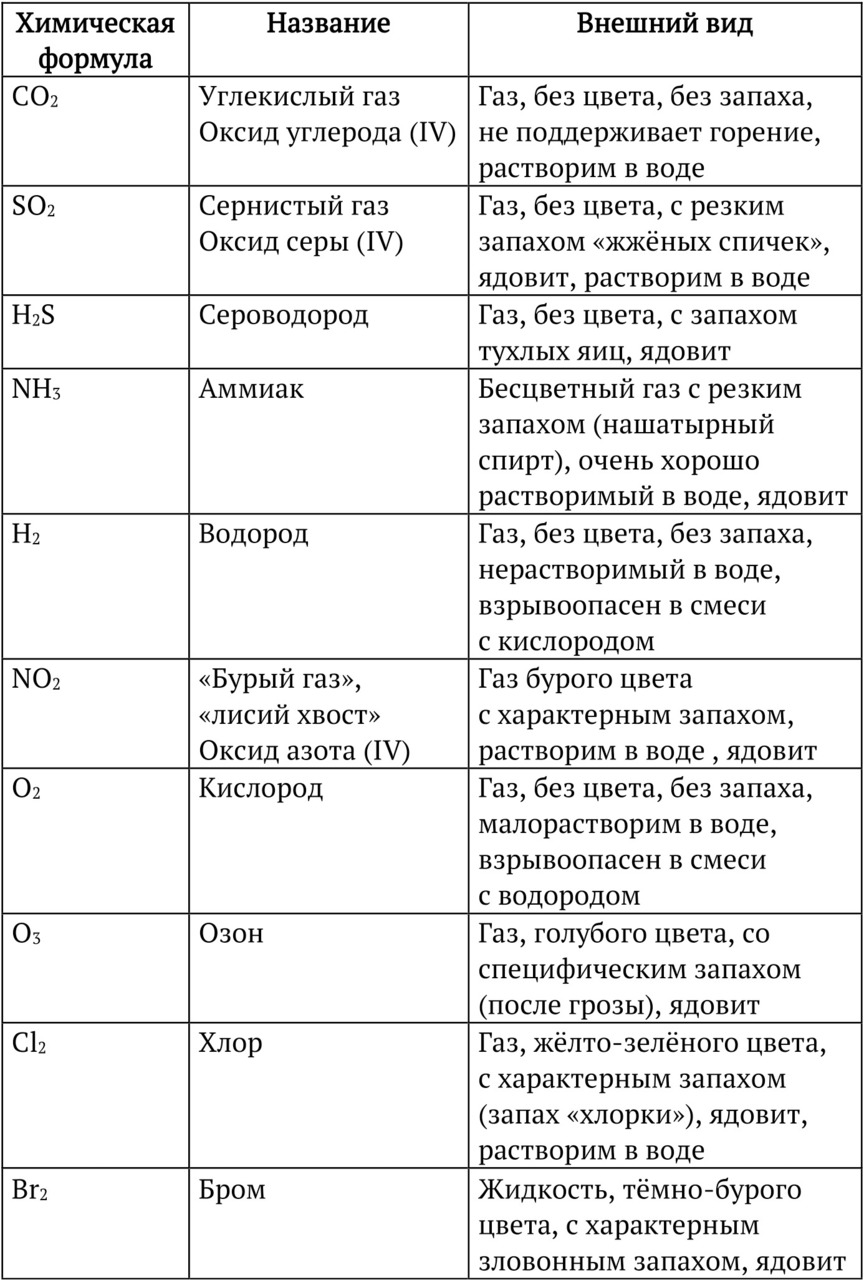
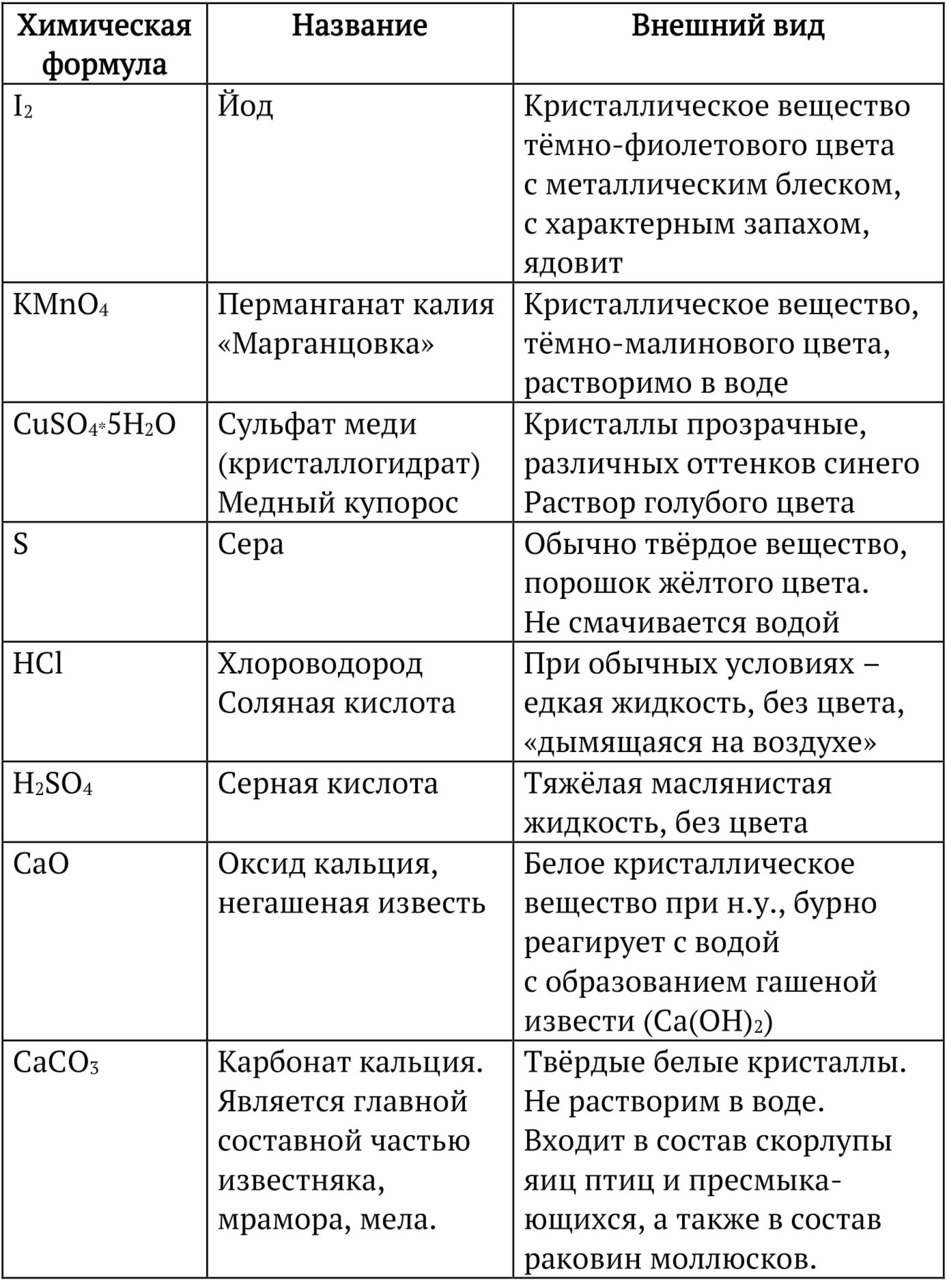
Задание:
1. Выучи любые 10 веществ из этой таблицы: формула, название, свойства.
Это пригодится в дальнейшем для решения задач и уравнений.
2. Пропиши, не подглядывая в таблицу, их здесь (пусть поработает моторная память)
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
3. Посмотри на формулы веществ в таблице. Некоторые состоят из символа одного элемента, другие из двух и даже трёх.
Вещества, состоящие из атомов ОДНОГО элемента — это ПРОСТЫЕ вещества.
Вещества, состоящие из атомов ДВУХ и БОЛЕЕ элементов — СЛОЖНЫЕ вещества.
Например, металл медь — Cu состоит только из атомов меди — это простое вещество. СаСО3 — состоит из атомов кальция, углерода и кислорода — это сложное вещество.
Задание:
Отметь простые и сложные вещества в таблице.
Двухатомные молекулы простых веществ:
Ещё раз посмотри в таблицу и на отмеченные простые вещества. Обрати внимание на их химические формулы. У некоторых есть индекс два, а у других его нет.
Двойка обозначает, что молекула данного вещества всегда состоит из двух атомов.
Такие вещества и их формулы надо запомнить (можешь сделать карточку)
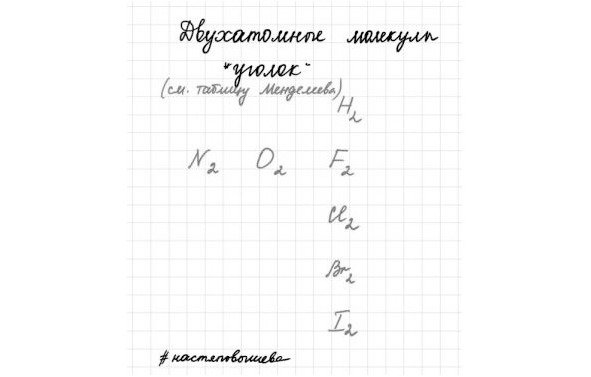
Запомнить легко, если посмотреть в таблицу Менделеева, эти вещества образуют «уголок» справа вверху.
Азот, кислород, фтор, хлор, бром, йод и водород.
КРАСНАЯ ПАСТА: Когда речь пойдёт об этих простых веществах, когда необходимо будет записать уравнение реакции с ними, то ты запишешь их с индексом 2.
Индекс у простых веществ может быть и другим.
Например, белый фосфор — Р4, ромбическая сера S8, фуллерен — С60.
При оформлении химических уравнений часто эти индексы не используют. А пишут просто Р, С, S.
Задание:
Запиши по памяти формулы всех семи двухатомных простых веществ.
Лабораторная работа или как удивить окружающих,
потушив свечу без всего.
На этом опыте мы исследуем свойства неизвестного газа.
А эксперимент проведём точно такой же, как вчера, только нам понадобится чуть больший размер ёмкости (например, стакан или чашка), большее количество реактивов (это сода и лимонная кислота), свечка и спички.
Пожалуйста, будьте внимательны и осторожны во время проведения эксперимента.
Правила техники безопасности:
1. Работайте на большой поверхности, на столе не должно быть ничего лишнего: никаких бумаг, легковоспламеняющихся предметов.
2. Обращайтесь со спичками очень осторожно.
3. Желательно, чтобы покрытие стола было жароустойчивое, на случай, если уроните спичку или свечку.
Ход эксперимента:
1. Предварительно растворите лимонную кислоту в воде. (Если вы берёте 3% уксус, то ничего дополнительно делать не надо);
2. В стакан (или другую емкость) насыпьте 2—3 чайных ложки соды;
3. Приготовьте свечку и спички;
4. Налейте в стакан с содой кислоту. Вы увидите бурное выделение пузырьков (знакомый признак реакции);
5. Зажгите свечу и аккуратно поднесите к стакану.
Результаты занесите в таблицу:
Характеристика полученного вещества:
Посмотрите на таблицу с веществами и сделайте вывод, какой газ мог выделиться в процессе реакции соды и кислоты.
Вспомни, где эта реакция происходит в быту?
Я тоже провела этот эксперимент. Он всегда вызывает много эмоций у младших ребят, кто пока ещё не знаком с химией. Можешь воспользоваться «магией» и провести такой фокус на любом мероприятии.
Видео, как это получилось у меня найдешь по ссылке ниже в ТГ канале Материалы к учебнику Химия 8 класс за 2 недели. Не забудь присоединиться к каналу, чтобы все ссылки из учебника стали активными, а материалы были всегда у тебя под рукой:

Урок 2. Строение вещества. Строение атома
Главный помощник в определении строения атома — это Периодическая Таблица Д. И. Менделеева. Мы говорили о ней в самом начале.
Это официальная «шпаргалка», в которой скрыт огромный пласт информации. Наша задача научиться ей пользоваться.
Важно распечатать именно чёрно-белую таблицу, без всяких подсказок, тогда будет легче ориентироваться на контрольной работе или экзамене.
На экзаменах, ВПР и других аттестациях цветных таблиц нет. Не ориентируйтесь на них.
Периодическая таблица Д. И. Менделеева (перед нами так называемая «короткая» таблица).
Таблица состоит из ячеек.
В каждой ячейке находится:
1) Символ химического элемента (ты уже его знаешь)
2) Русское название химического элемента
3) Порядковый номер вверху ячейки (у каждого свой)
4) Относительная атомная масса
Группы — это вертикальные столбцы, обозначаются римскими цифрами.
Периоды — это горизонтальные ряды. Бывают периоды малые и большие. Малые, когда по одной строчке и большие, когда по две.
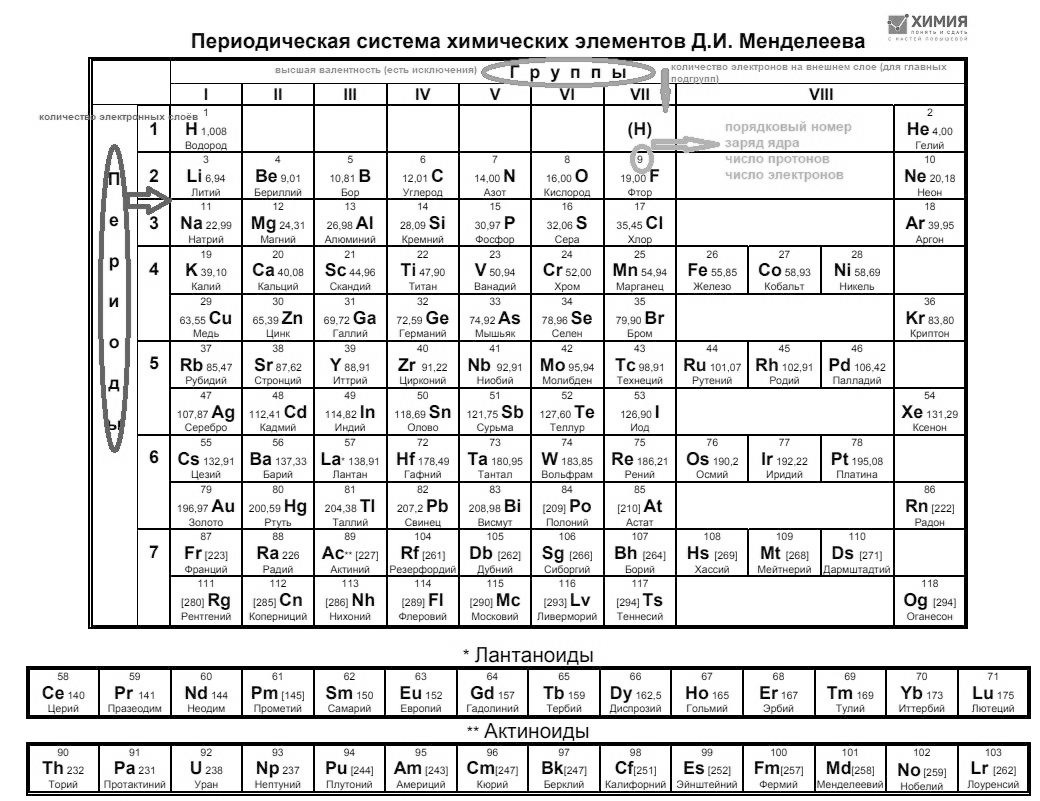
Найдите в таблице фтор и давайте дадим характеристику элемента, опираясь только на Периодическую систему:
Русское название элемента — фтор. Символ F.
Порядковый номер элемента 9.
Число, записанное через запятую, с десятыми и сотыми, это относительная атомная масса (обозначается Аr). У фтора это число целое, 19. Записывают так: Аr (F) = 19.
Например, у марганца Аr (Mn) = 54,94,
ВАЖНО! При решении задач (если не указано иначе) будем брать целое значение относительной атомной массы. Для марганца — это 55, то есть всегда округляем относительную атомную массу до целых.
КРАСНАЯ ПАСТА: Исключение ХЛОР — при решении задач относительную атомную массу у хлора берём 35,5.
Что ещё мы можем сказать о фторе по Периодической системе/таблице Менделеева?
Что он находится в седьмой (VII) группе и во втором периоде.
Если вы внимательно посмотрите на таблицу, то увидите, что в группах элементы стоят с одной стороны, а другие с другой.
Это главные и побочные подгруппы.
Как их отличить?
Единственное верное отличие это то, что главная подгруппа находится под верхним первым элементом группы. Например, элементы главной подгруппы пятой группы это N, P, As, Sb, Bi. Элементы, что находятся рядом, не под азотом, это побочная: V, Nb, Ta.
Давайте выполним задание и дадим характеристику химическому элементу углероду:
Символ
порядковый номер
период
группа
подгруппа
Ar =
С точки зрения химии, АТОМ — это наименьшая, химически неделимая частица. Из чего же он состоит?
Он состоит из ядра, которое находится в центре, и электронов, которые располагаются/находятся в постоянном движении вокруг ядра.
Ядро имеет положительный заряд. Электроны заряжены отрицательно.
Ядро в свою очередь состоит из протонов и нейтронов. Протоны имеют положительный заряд, нейтроны (они так и называются) — нейтральны (не несут на себе заряд, ноль).
В целом, атом электронейтрален, то есть его заряд равен нулю. Отсюда сделаем вывод, что количество электронов должно совпадать с зарядом ядра атома.
КРАСНАЯ ПАСТА
Заряд ядра
Число электронов
Число протонов
совпадают с порядковым номером элемента в таблице Менделеева.
Задание: определи заряд ядра, число электронов и протонов в атоме фтора. Для этого найди фтор в таблице и его порядковый номер. Порядковый номер фтора — ___. Значит __
Вокруг ядра «бегают» электроны.
Та область пространства вокруг ядра, где находятся электроны, называется электронным облаком.
Электроны имеют разную энергию и находятся на разном расстоянии от ядра.
Расстояния, где могут находиться электроны, называются электронными уровнями (электронными слоями, энергетическими уровнями, энергетическими слоями, электронными оболочками — это синонимы и все названия верны).
КРАСНАЯ ПАСТА
Номер периода = число электронных слоёв/уровней/оболочек в атоме.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
